
题目列表(包括答案和解析)
29.(10分)某硫酸厂在进行黄铁矿(主要成分是FeS2)成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应,再用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:①SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+
② Cr2O2-7+ Fe2++ H+= Cr3++ Fe3+ H2O
(1)在反应②的横线上填写相应的化学计量数。
(2)灼烧6g纯FeS2时放出42.65kJ热量,写出灼烧FeS2的热化学方程式:
。
(3)反应②中1mol氧化剂 (填“得到”或“失去”) mol电子。
(4)样品中FeS2的质量分数(假设杂质不参加反应) 。
28.(12分)下面是测定硫酸铜晶体水含量的实验,请按要求填空。
(1)加热前应将晶体放在研钵研碎,加热是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失去结晶水的方法是 。
(3)下面是某同学的一次实验数据,请完成计算,将答案填入表中的空格中。
|
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
测得晶体中结晶水的个数 |
误差(填“偏高”或“偏低”) |
|
11.7g |
22.7g |
18.6g |
|
|
(4)这次实验产生误差的原因可能是 (填字母的序号)。
A.硫酸铜晶体中含有挥发性的杂质
B.加热过程中有晶体溅出
C.实验前晶体表面有湿存水
D.最后两次称量质量相差较大
27.(12分)氯碱厂电解饱和食盐制取NaOH的工艺流程示意图如下:
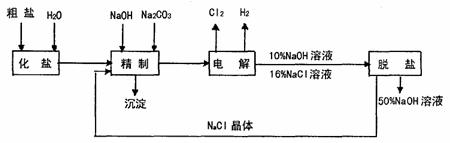
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为
,与电源负极相连的电极附近溶液pH (填“不变”、“升高”或“降低”)
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
。
(3)如果粗盐中SO2-4含量较高,必须添加钡试剂除去SO2-4,该试剂可以是 (填字母序号)。
a.Ba(OH2) b.Ba(NO3)2 c.BaCl2
(4)为有效去除Ca2+、Mg2+、SO2-4,加入试剂的合理顺序为 (填字母序号)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.衔加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 (填操作名称)除去NaCl。
26.(11分)两个学习小组用下图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
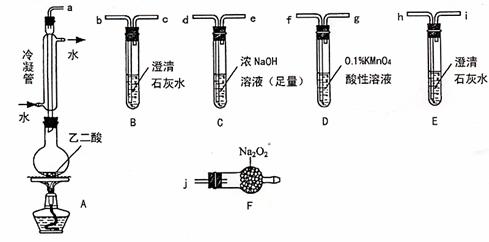
(1)甲组:
①按接口顺序a-b-c-de-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有 ;装置C的作用是 ;E中溶液变浑浊,D中的现象是 ,证明分解产物有
。
②乙二酸受热分解的化学方程式为 。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为 。
②从A~F中选用装置进行实验,证明甲组通入D装置的气体能否与Na2O2反应。最简单的装置接口连接顺序是 ;实验后用F中的固体进行验证的方法是 (可另选试剂)。
25.(15分)已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性。A~I均为中学化学中常见物质,它们之间的转化关系如下图所示。(部分生物和反应条件已略去)

请回答下列问题:
(1)写出组成物质C的元素在元素周期表中的位置: ;
(2)写出反应①的化学方程式: 。
(3)由E的饱和溶液可以制得胶体,具体制备方法是
。用化学方程式表示该过程的原理: 。若要提纯该胶体,采用的操作方法叫 ,提纯后的液体具有的性质是 (填字母序号)。
a.光束通过该液体时形成光亮的“通路”
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧,得到红棕色固体
(4)G的水溶液显 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示) 。
(5)在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2介离子,则该反应的离子方程式是 。
24.(12分)某100mL溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),
且各离子的物质的量均为0.1mol。
|
阴离子 |
SO2-4、NO-3、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH+4、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
③若向原溶液中加入BaCl2溶液,有白色沉淀生成
试回答下列问题:
(1)原溶液中所含阳离子是(填离子符号,下同) ,阴离子是 。
(2)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验中发生的所有反应的离子方程式是 。
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤后将沉淀洗涤、灼烧,最终所得固体的质量是 。
23.(8分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 (填字母序号)。
a.氧化性:KbrO3>H3AsO4` b.氧化性:H3AsO4>KbrO3
c.还原性:AsH3>X d.还原性:X>AsH3
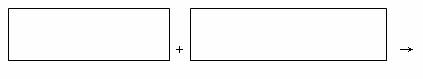
(4)将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:
22.某溶液中存在XO-3,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )
A.Na+、H+、SO2-4、I- B.Na+、Ca2+、CO2-3、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO2-4、Cl-、CO2-3
第Ⅱ卷(非选择题 共80分)
21.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+===
2Fe3++2H2O;2Fe3++H2O2===2Fe3++O2↑+2H+。下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.生产H2O2过程中需要加入Fe2+
20.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程式为:2Fe(OH)3+3ClO-+4HO-=2FeO2-4+3Cl-+5H2O
干法制备的主要反应方程式为:FeSO4+2Na2O2=Na2FeO4+Na2SO4
下列有关说法不正确的是 ( )
A.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
B.湿法中每生成1molNa2FeO4转移3mol电子
C.干法中每生成1molNa2FeO4转移4mol电子
D.高铁酸钾中铁显+3价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com