
题目列表(包括答案和解析)
21.(09江苏卷7)在下列各溶液中,离子一定能大量共存的是 ( )
A.强碱性溶液中: 、
、 、
、 、
、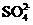
B. 含有0.1 mol·L-1
 的溶液中:
的溶液中: 、
、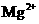 、
、 、
、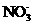
C. 含有0.1 mol·L-1 溶液在中:
溶液在中: 、
、 、
、 、
、
D. 室温下,pH=1的溶液中: 、
、 、
、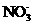 、
、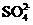
20.(09广东化学17) 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程中可适当混入Fe2+
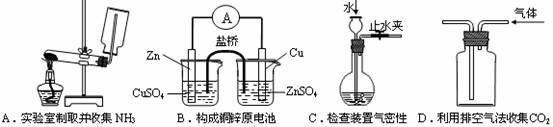
19.下列装置或操作能达到实验目的的是 ( )
18.(09上海卷7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③ B.②①③ C.③②① D.③①②
17.取xg铜镁合金溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mL
的N2O4气体(都已这算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成
沉淀质量为17.02g。下列判断不正确的是 ( )
A.参加反应的硝酸是0.92mol
B.合金中镁的质量5.9g
C.反应过程中转移的电子数为0.46mol
D.合金中含有铜0.092mol
16.X、Y、Z、W为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比 X的原子序数多5,Z原子的最外层电子数比Y最外层电子数多3,W是短周期中原子半径最小的元素。下列叙述正确的是 ( )
A.X与W形成的化合物中只含有极性键
B.Z单质与X单质直接反应可生成两种化合物
C.X和Y形成的化合物既能与酸反应又能与碱反应
D.原子半径的大小顺序:X>Y>Z
15.为达到预期的实验目的,下列操作正确的是 ( )
① 配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
② 用10ml的量筒量取4.80ml的浓硫酸
③ 蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干
④ 向无色溶液加BaCl2溶液生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一
定含有SO42-
⑤ 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴入NaOH溶液至过量
⑥ 中和热测定的实验中使用的玻璃仪器只有2种
⑦ 实验室可利用浓氨水和碱石灰混合的方法制取少量氨气
⑧ 除NO中混有的NO2气体可通过水洗,再干燥后向上排空气法收集
A.③⑤⑧ B.④⑤⑥ C.①⑤⑦ D.①⑦⑧
14.某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则 下列关于溶液组成的判断正确的是 ( )
① 肯定不含I-; ② 肯定不含Cu2+; ③ 肯定含有SO32-;
④ 可能含有I-; ⑤ 可能含有SO32-;
A.①②③ B.②④⑤ C.①②⑤ D.②③④
13.将一定量的钠铝合金置于水中,合金全部溶解,
得到20mLPH=14的溶液,然后用1mol/L的盐酸
滴定,沉淀质量与消耗盐酸的体积关系如图所示,
则下列选项正确的是 ( )
A.原合金质量为0.92g
B.标准状态下产生氢气896ml
C.图中m值为1.56g
D.图中V2为60ml
12.N2与H2反应过程中能量变化曲线如图所示。
若在一个固定容积的密闭容器中充入1molN2
 和3molH2使反应N2+3H2 2NH3达到平
和3molH2使反应N2+3H2 2NH3达到平
衡测得反应放出热量为Q1。下列叙述正确的
是 ( )
A.该反应的热化学方程式为:
 N2(g)+3H2(g) 2NH3(g)
△H=-Q1kJ·mol-1
N2(g)+3H2(g) 2NH3(g)
△H=-Q1kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.上述条件下达平衡时H2的转化率为3Q1/92
D.在温度体积一定的条件下,若通入2molN2和
 6molH2反应后放出的热量为Q2kJ,则 184>Q2>2Q1
6molH2反应后放出的热量为Q2kJ,则 184>Q2>2Q1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com