
题目列表(包括答案和解析)
5、下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是 ( )
A.Ba2+、NO3-、NH4+、Cl- B.Ca2+、HCO3-、NH4+、AlO2-
C.K+、Ba2+、Cl-、HSO3- D.Mg2+、NH4+、SO42-、K+
4.下列各组离子中,因发生氧化还原反应 而不能大量共存的是 ( )
A.Fe3+、H+、SO42-、ClO- B.Fe3+、Fe2+、SO42-、NO3-
C.Al3+、Na+、SO42-、CO32- D.K+ 、H+、Br-、MnO4-
3.下列反应的离子方程式书写正确的是 ( )
A.用氨水吸收少量SO2气体:2NH3·H2O + SO2 = 2NH4+ + SO32- + H2O
B.FeI2溶液中通入Cl2至Fe2+ 恰好完全被氧化:2Fe2+ + Cl2 = 2Fe3+ +2Cl-
C.NH4HCO3溶液与过量的NaOH溶液共热:NH4+ +OH- NH3↑+ H2O
NH3↑+ H2O
D.Cl2通入水中:Cl2 + H2O = 2H+ + Cl- + ClO-
2、下列离子方程式书写正确的是 ( )
A.过量的SO2通入NaOH溶液中:SO2+2OH-===SO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ === 2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH-===BaCO3↓+2H2O+CO32 -
1.下列类型的反应,一定发生电子转移的是 ( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
22.(12分)为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
|
实验次数 |
混合物的质量/g |
所加Ba(OH)2溶液的体积/L |
测得沉淀的质量/g |
|
1 |
1.716 |
0.5 |
2.758 |
|
2 |
3.432 |
0.5 |
|
|
3 |
5.148 |
0.5 |
8.274 |
|
4 |
6.864 |
0.5 |
11.032 |
|
5 |
8.580 |
0.5 |
11.032 |
|
6 |
10.296 |
0.5 |
11.032 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g;
(2)求所用Ba(OH)2的溶液的物质的量浓度__________ g·mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比 ;
(4)在25℃时,取下第3组实验所得溶液体积的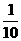 ,加水配成1000mL溶液,求此溶液pH=__________。
,加水配成1000mL溶液,求此溶液pH=__________。
21.(10分)A、B、C、D、E是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;A原子的最外层电子数与次外层电子数相等; A与E、B与D这两对原子的最外层电子数之和均为9。五种元素的单质在一定条件下都可与NaOH溶液反应。把C单质的一种同素异形体放在长玻璃管的中部(一端用软木塞或湿纸团塞紧,另一端敞开),加强热后,玻璃管内有黄色蒸气,冷却后此管内壁附着C单质的另外一种颜色的同素异形体。请回答下列问题:
(1)B、D、E的原子半径由小到大的顺序是 (用元素符号表示)。
(2)DE2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体。
(3)A与B化学性质相似,则A与浓的NaOH溶液反应的化学方程式是 。
(4)用一个化学方程式表示1mol C元素的最高氧化物的水合物和2.7 mol NaOH在溶液中恰好完全反应,此化学方程式是 。
20.(10分) A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右图所示(图中部分产物未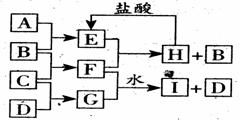 列出):请填写下列空白
列出):请填写下列空白
(1)A是 ,C的电子式 。
(2)H与盐酸反应生成E的离子方程式 是 。
(3)E与F反应的化学方程式是 ______._____________________________________
(4)F与G的水溶液反应生成I和D的离子方 程式是 。
19.(10分)设计出燃料电池使汽油氧化直接产生电流是对21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)以庚烷(C7H16)代表汽油,这个电池放电时发生的化学反应的化学方程式是:
(2)①这个电池的正极发生的反应是:
②负极发生的反应是:
③固体电解质里的O2-的移动方向是:
④向外电路释放电子的电极是:
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
18.(12分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如: 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
(填编号),其pH为 (填数值);pH最大的是 (填编号);
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③侯氏制碱法中,向碳酸氢铵饱和溶液中加入饱和食盐水可获得小苏打晶体
④蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一个规律:
。
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com