
题目列表(包括答案和解析)
21.答案(1)[CO][H2O] [CO2][H2](2)吸热(3)b、c(4)830
23.“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
⑴下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
⑵将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6
C6H12O6
b.CO2 + 3H2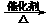 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4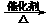 CH3COOH
CH3COOH
d.2CO2 + 6H2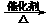 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
⑶文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
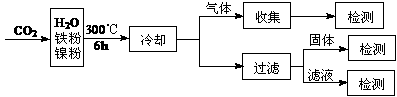
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。
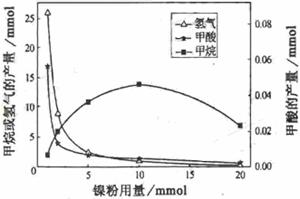 CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果
得出结论:HCOOH是
CO2转化为CH4的中间体,
即:CO2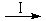 HCOOH
HCOOH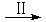 CH4
CH4
①写出产生H2的反应方程
式 。
②由图可知,镍粉是 。(填字母)
a.反应的催化剂
b.反应的催化剂
c.反应的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应ⅠⅡ的速率均不变
d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快
e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
A |
C |
D |
BC |
A |
D |
A |
A |
D |
AC |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
D |
D |
C |
B |
B |
B |
C |
A |
C |
C |
22.在830 K时,可逆反应CO+H2O H2+CO2,及其平衡具有某些特殊性。若起始浓度[CO]为2 mol/L,[H2O]为3 mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度加大到6 mol/L,则CO的转化率为75%。
H2+CO2,及其平衡具有某些特殊性。若起始浓度[CO]为2 mol/L,[H2O]为3 mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度加大到6 mol/L,则CO的转化率为75%。
请观察上述有关数据,找出规律,填写以下空白。
设830K时,起始浓度[CO]为a mol/L,[H2O]为b mol/L,反应达到平衡时[H2]为c mol/L。(1)当b不变,a减小,重新达到平衡时,CO的转化率 ,H2O的转化率 。(填“增大”、“减少”或“不变”)
(2)a=5,c= 20/9 时,b= 。 (3)当a=b时,c/a = 。
(4)a、b、c在该平衡中的关系式是 。
21.在一定体积的密闭容器中,进行如下化学反应:C02(g)+H2(g)  ?C0(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
?C0(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(C0)不变 c.v正(H2)= v逆(H20) d.c(CO2)=c(C0)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H20),试判断此时的温度为 ℃。
20.一定条件下,向一带活塞的密闭容器中充入2 molSO2和1 molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.保持温度和容器体积不变,充入1 molSO2(g)
B.保持温度和容器内压强不变,充入1 molSO3(g)
C.保持温度和容器内压强不变,充入1 molO2(g)
D.保持温度和容器内压强不变,充入1 molAr(g)
19.在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气) ?2HI(气)。已知H2和I2的起始浓度均为0.1mol
?2HI(气)。已知H2和I2的起始浓度均为0.1mol L-1,达平衡时HI的浓度为0.16mol
L-1,达平衡时HI的浓度为0.16mol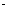 L-1。若H2和I2的起始浓度均变为0.2 mol
L-1。若H2和I2的起始浓度均变为0.2 mol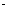 L-1时,则平衡时H2的浓度(mol
L-1时,则平衡时H2的浓度(mol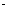 L-1)是 ( )
L-1)是 ( )
A.0.16 B.0.08 C.0.04 D.0.02
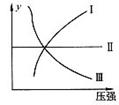
18.下图I、Ⅱ、Щ分别代表反应①③、②、④,则y轴是指 ( )
①N2+3H2 2NH3
2NH3 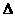 H<0
H<0
 ②H2+I2(g)
②H2+I2(g) 2HI
2HI 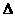 H<0
H<0
 ③CO+2H2
③CO+2H2 CH3OH(g)
CH3OH(g)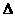 H<0
H<0
④2SO3  2SO2+O2
2SO2+O2 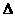 H>0
H>0
A.平衡混合气中一种生成物的百分含量
B.平衡混合气中一种反应物的百分含量
C.平衡混合气中一种生成物的转化率
D.平衡混合气中一种反应物的转化率
17.在一密闭容器中,用等物质的量的A和B发生如下反应:A(气)+2B(气) 2C(气)反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是( )
2C(气)反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是( )
A.n(A)=n(C) B.n(B)=n(C) C.n(A)+n(B)=n(C) D.n(B)+n(C)=n(A)
16.已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是 ( )
A.Q1=2Q2=92.4 B.Ql>2Q2 C.Q1<2Q2 D.Q1=2Q2≠92.4
15、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2, 在相同温度下发生反应 2SO2+O2
 2SO3并达到平衡,在这过程中甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 (
)
2SO3并达到平衡,在这过程中甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 (
)
A 等于P% B 大于P% C 小于P% D 无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com