
题目列表(包括答案和解析)
1.下列气体中,对人体没有毒害作用的是( )
A.N2 B.Cl2 C.NO2 D.SO2
28、(9分)某学校课外兴趣小组为了研究家用含少量硫元素的煤的燃烧效率(已知煤的燃烧效率=完全燃烧的碳的质量÷碳的总质量),他们用W g煤在实验室中的密闭体系中燃烧,将燃烧后的气体分成两等份,甲、乙两组再分别进行下列实验:
甲:把其中的一份气体依次通过①足量高锰酸钾溶液②品红稀溶液③足量的澄清石灰水,然后过滤、洗涤、干燥,称得固体的质量为a g;
乙:把另一份气体依次通过①足量的碱石灰②m g足量的灼热CuO,充分反应后称量②的固体质量为b g。
根据上述实验回答下列问题:
⑴甲能否得出燃烧效率: (填“能”或“否”),
甲实验中步骤①的目的是 ,步骤②的目的是 。
⑵根据甲、乙的数据,该煤的燃烧效率为 ,该煤中碳的含量为 (用含w、m、a、b的表达式表示,不必化简)。
高三化学自选模块模拟试卷
“化学与生活”模块(10分)
碘缺乏症遍及全球,多发生丁山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜玛拉雅山区是高发病地区。我国云南、河南等十余个省的山区的发病率也较高。为控制该病的发生,较为有效的方法是加碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾。据此回答下面问题。
(1)碘是合成下列哪种激素的主要原料之一( )
A胰岛素 B甲状腺激素 C生长激素 D糖尿病
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患( )
A甲状腺机能亢进 B佝偻病 C地方性甲状腺肿 D雄性激素减少
(3)可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾,反应的离子方程式
为: ,氧化产物和还原产物的物质的量之比为 ,能
观察到的明显现象是 。
“化学与技术”模块(10分)
人类对氢气的研究更趋深入,“氢能”将是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
(2)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用过
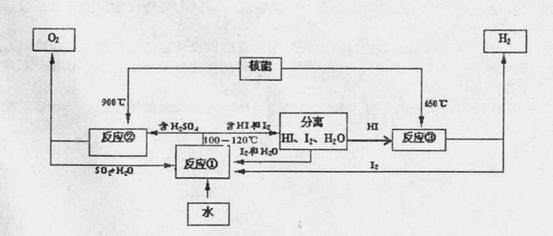 量的碘。(提示:反应②的产物是O2、SO2和H2O)
量的碘。(提示:反应②的产物是O2、SO2和H2O)
完成下列反应的化学方程式:反应① ;反应② 。此法
 制取氢气的最大优点是
。
制取氢气的最大优点是
。
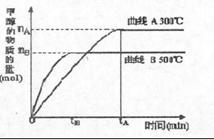
(3)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)===== CH3OH(g) 甲醇的物质的量与反应温度的关系如右图所示:
①合成甲醇反应,其反应热 H 0.(填“>”、“<”或“=”)
H 0.(填“>”、“<”或“=”)
②据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) 。
27、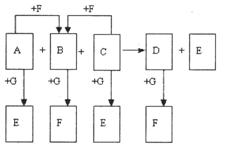 (10分)已知右图中所有物质均为化合物,A、 C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性。B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色。A、D的水溶液都有杀菌消毒作用。 A、B、C反应时,物质的量之比为3:2:4。其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整)。请写出:
(10分)已知右图中所有物质均为化合物,A、 C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性。B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色。A、D的水溶液都有杀菌消毒作用。 A、B、C反应时,物质的量之比为3:2:4。其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整)。请写出:
(1)A的化学式_____________,C的电子式:_________________;
(2)A、B、C三者发生反应的离子方程式:__________________________
(3)已知D和G反应时还有使带火星的木条复燃的气体产生,则D和G反应的化学方
程式为:____________________________________。
26、(15分)以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
|
|
|
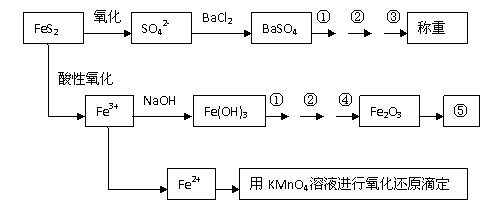

请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①___________、②__________、③________。
操作④、⑤用到的主要仪器是:④_____________、⑤_____________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是
。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,(A)用带有刻度的烧杯配制成100 mL试样溶液。(B)用量筒量取25.00 mL待测溶液,(C)并置于锥形瓶中。(D)用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,(E)当溶液变成淡紫红色时,停止滴定,如30秒内不褪色,(F)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。
请指出该实验过程中错误操作步骤的编号:_______________________________。
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是________________________________________________ _____
。
(5)称取矿石试样1.60 g, 按方法Ⅰ分析,称得BaSO4的质量为4.66 g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是________。
25、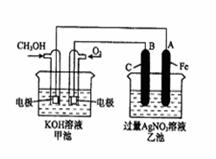 (10分)右图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
(10分)右图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。
甲池是 装置,乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状
况下)
24、(10分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体
③ 分子晶体 ④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________, 用一个离子方程式加以证明 。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
23、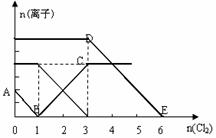 向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是
向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是
A.线段BC代表Fe3+ 物质的量的变化情况
B.原混合溶液中 c(FeBr2)= 6mol/L
C.当通入Cl2 2mol时,溶液中已发生的离子反
应可表示为:2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━
D.原溶液中n(Fe2+): n(I━): n(Br━)=2:1:3
第II卷(非选择题 共54分)
22、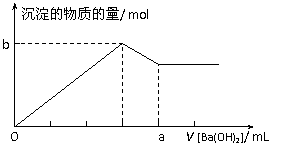 已知Ba(AlO2)2可溶于水。下图表示的是向100
mL 0.02 mol·L-1 KAl(SO4)2溶液中逐滴加入0.05
mol·L-1 Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系。下列说法不正确的是
已知Ba(AlO2)2可溶于水。下图表示的是向100
mL 0.02 mol·L-1 KAl(SO4)2溶液中逐滴加入0.05
mol·L-1 Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系。下列说法不正确的是
A.所加的Ba(OH)2溶液的pH=13
B.a点的值是80 mL
C.b点的值是0.005 mol
D.当V [Ba(OH)2]=30 mL时,生成沉淀的质量是0.699 g
21、仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是
A.溴水 B.FeCl3溶液 C.酸性KMnO4 D.AgNO3溶液
19、向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是
A.溶液中c(Na+)=2c(SO42-) B.a/2 mol>沉淀的物质的量>0
C.沉淀的物质的量= a/2 mol D.原溶液中c(H2SO4) = a/2 mol/L
|
A.X元素形成的气态氢化物分子的空间结构是三角锥形
B.Z与Y元素形成的化合物可以是原子晶体
C.W单质受热蒸发时吸收的热量用于克服分子间作用力
D.Z的最高价氧化物能溶于X的最高价氧化物的水化物中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com