
题目列表(包括答案和解析)
5.下列物质中,不能与盐酸反应,但能与氢氧化钠溶液反应的是
A.NaHCO3 B.(NH4)2SO3 C.SiO2 D.Al(OH)3
[考点 3]合金的概念及其重要应用
[备 注]合金:两种以上金属或非金属熔合而成的具有金属特性的物质。由于合金的性能一般比纯金属优越,因此合金的应用更广(例如刀具、弹簧等)!
[例题 1]某合金与铁的物理性质的比较如下表所示:
|
|
熔点/℃ |
密度(g /cm3) |
硬度(金刚石为10) |
导电性(银为100) |
|
某合金 |
2500 |
3.00 |
7.4 |
2.3 |
|
铁 |
1535 |
7.86 |
4.5 |
17 |
还知该合金耐腐蚀,强度大,从以上性能看,该合金不适合用作
A.导线 B.门窗框 C.炉具 D.飞机外壳
[考点 4]常见非金属元素单质及其重要化合物的主要性质及应用
[备 注]氯气的化学性质(强氧化性等),各种气体物质(例如SO2、NO、NO2、Cl2、NH3等)的性质对比(例如颜色、气味、溶解性、氧还性、酸碱性、干燥等),硫酸、硝酸、硅酸等的特点(例如氧化性、酸性、独有特性)、盐类(例如纯碱、小苏打)的性质差异(例如与酸碱的反应、热稳定性等,相互转化)
[例 题]1.可用于干燥氯气的干燥剂是
A.稀硫酸 B.烧碱固体
C.生石灰 D.无水氯化钙
4.下列说法正确的是:
A. 铝制品比铁制品不易生锈,所以铝的金属性弱于铁
B. 锌铁合金与稀硫酸构成原电池,在锌表面可以看到气泡
C.I-的还原性强于Cl-,所以I2的氧化性强于Cl2
D.相同条件时钾、钠与水反应,钾比钠更剧烈,所以钾的金属性强于钠
3.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是

2.下列各组物质相互反应后,没有碱生成的是
A、CaO与水 B、红热的铁粉与水蒸气 C、金属镁与热水 D、Na2O2与水
1.下列物质加入到氢氧化钠溶液中,没有气体生成的是
A、金属钠 B、过氧化钠 C、金属镁 D、金属铝
4.下列反应的离子方程式不正确的是
A.铁放入盐酸中:Fe + 6H+ = 2Fe3++H2↑
B.铁放入稀硝酸中: Fe + 4H++NO3- = Fe 3++NO↑+2H2O
C.铜与稀硝酸反应 3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O
D.Fe(NO3)3溶液中加过量氨水:Fe3+ + 3NH3·H2O = Fe(OH)3↓ + 3NH4+
[练 习]
3.在人类社会的发展中,金属起着重要作用。下列表述不正确的是
A.氧化铝的熔点很高,是一种较好的耐火材料
B.氧化亚铜呈黑色,可作为制造铜盐的原料
C.金属在自然界中多以化合态存在,只有极少数金属以游离态存在
D.氢氧化铝能作为医用胃酸中和剂,是由于它的碱性不强,却可以与酸反应
2.将铁屑溶于下列物质中,再滴加KSCN溶液,溶液呈红色的是
A.硫酸 B.氯水 C.硝酸钾 D.氯化铜
(二)(5)因此时容器的容积不变,而(1)中容器的容积缩小,(5)小题中容器相当于在(1)的基础上减压,则平衡逆向移动,故反应达到平衡后a>b,即应填(甲)。
针对训练:
1、在t℃时,向2L密闭容器中放入1molA和1molB,发生下列反应:
A(g)+B(g)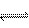 C(g)+2D(g),平衡时C的含量为m%,保持其他条件不变,若按下列配比将物质放入容器中达到平衡时,C的含量仍为m%的是
( )
C(g)+2D(g),平衡时C的含量为m%,保持其他条件不变,若按下列配比将物质放入容器中达到平衡时,C的含量仍为m%的是
( )
A、2molA和1molB B、2molD和A、B、C各1mol
C、1molC和2molD D、1molC和1molD
2、在一定温度下,把2mol SO2和1mol
O2通入一个一定容积的密闭容器里,发生如下反应:2SO2 +O2 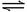 2 SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保持达到平衡时,反应混合物中三种气体的体积分数仍和上述平衡时的完全相同。请填写下列空白:
2 SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保持达到平衡时,反应混合物中三种气体的体积分数仍和上述平衡时的完全相同。请填写下列空白:
⑴若a=0,b=0,则c= _____________。
⑵若a=0.5,则b= _________ 和c= __________。
⑶a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c): __________________________________________________。
答案:(1)2mol
(2)b=0.25mol,c=1.5mol
(3)a+c=2 b+c/2=1(或2b+c=2)
3、在一个固定体积的密闭容器中,加入2mol A和1mol B,发生反应:
 2A(g)+B(g) 3C(g)+D(g)
达平衡时,c (C)=W mol/L。若维持容器内体积和温度不变,按下列四种配比作起始物质,达平衡后,C浓度仍为W
mol/L的是( AD
)
2A(g)+B(g) 3C(g)+D(g)
达平衡时,c (C)=W mol/L。若维持容器内体积和温度不变,按下列四种配比作起始物质,达平衡后,C浓度仍为W
mol/L的是( AD
)
(A)1mol A+0.5mol B+1.5mol C+0.5 D
(B)2mol A+1mol B+3mol C+1mol D
(C)3mol C+1mol D+1mol B
(D)3mol C+1mol D
4、在一恒温恒容密闭容器中,A、B气体可建立如下平衡: 2A(g)+2B(g)  C(g)+3D(g)现分别从两条途径建立平衡:Ⅰ. A、B的起始量均为2mol;Ⅱ. C、D的起始量分别为2mol和6mol。下列叙述不正确的是:-----------------------------(B)
A、Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B、Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C、达到平衡时,途径Ⅰ的 和途径Ⅱ体系内混合气体平均相对分子质量相同
D、达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的1/2
5、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
C(g)+3D(g)现分别从两条途径建立平衡:Ⅰ. A、B的起始量均为2mol;Ⅱ. C、D的起始量分别为2mol和6mol。下列叙述不正确的是:-----------------------------(B)
A、Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B、Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C、达到平衡时,途径Ⅰ的 和途径Ⅱ体系内混合气体平均相对分子质量相同
D、达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的1/2
5、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+2B(g) 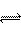 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。
维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是 ( D )
A、3mol C+1mol D B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C D、4mol A+2mol B
6、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) 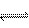 xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为 ( BC )
xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为 ( BC )
A、1 B、2 C、3 D、4
7、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+B(g) 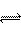 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L(或C的体积分数仍是a%)的是 ( ABD )
A、3mol C+1mol D B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C D、4mol A+2mol B
8、在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:
3A(气)+2B(气)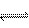 xC(气)+yD(气)
xC(气)+yD(气)
达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA 、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则X、Y的值分别为 ( CD )
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2
9、在一个容积固定的密闭容器中充入1molHI,建立如下平衡:H2(g)+I2 (g)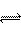 2HI(g),测得HI的转化率为a%。其他条件不变,在上述平衡体系中再充入1molHI,待平衡建立时HI的转化率为b%,则a、b的关系为
(C )
2HI(g),测得HI的转化率为a%。其他条件不变,在上述平衡体系中再充入1molHI,待平衡建立时HI的转化率为b%,则a、b的关系为
(C )
A.a>b B.a<b C.a=b D.无法确定
10、一个真空密闭恒容容器中盛有1molPCl5,加热到200℃发生如下反应:
PCl5(g) 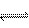 PCl3
(g)+Cl2 (g) ,反应达到平衡时,混合气体中PCl5,所占体积分数为M%,。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5,所占体积分数为N%。则M和N的关系是
( C
)
PCl3
(g)+Cl2 (g) ,反应达到平衡时,混合气体中PCl5,所占体积分数为M%,。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5,所占体积分数为N%。则M和N的关系是
( C
)
(A) M>N (B) M=N (C) M < N (D)无法确定
11、已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是 (AB)
A.向甲容器中充入一定量的氦气 B.向乙容器中充入一定量的SO3气体
C.升高乙容器的温度 D.增大甲容器的压强
12、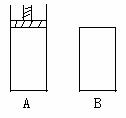 有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内
有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内
保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等量
的体积比为2:1的SO2和O2的混合气体,并使A和B的容积相等。
在保持4000C的条件下使之发生如下反应:2 SO2+O2 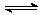 2SO3。
2SO3。
(1)达到平衡时所需要的时间A容器比B容器 ,A容器中
SO2的转化率比B容器 。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡 移动,B容器化学平衡 移动。
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器SO3物质的量分数 ;B容器中SO3的物质的量分数 。(填增大、减小、不变)
答案(1)短、大(2)逆向、不(3)不变、增大
(二)若维持温度不变,在一个与(一)反应前起始体积相同,且容积固定的容器中发生上述反应。
(5)开始时放入1mol A和1mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较__________(填编号)。
(甲)a>b(乙)a<b(丙)a=b(丁)不能比较a和b的大小
作出此判断的理由是____________。
解析:(一)(1)由反应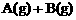

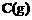 知,反应达平衡后,若有a mol C生成,则必有a mol A物质消耗,此时剩余A的物质的量为(1-a)mol。
知,反应达平衡后,若有a mol C生成,则必有a mol A物质消耗,此时剩余A的物质的量为(1-a)mol。
(2)在恒温、恒压下,若投放3mol A和3mol B,则所占有的体积为(1)中的3倍。由于A、B的投放比例与(1)相同,故平衡时与(1)等效,而C的物质的量为3a mol。
(3)由于达到平衡时C的物质的量为3a mol,故此平衡状态与(2)完全相同。若把C的物质的量完全转化为A和B,A、B的物质的量应与(2)完全相等。
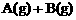

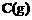
起始(mol): x 2 1
将C转化为A、B(mol): x+1 2+1 0
平衡时(mol): y 3-3a 3a
据题意有: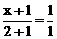 ,解得
,解得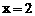 ;
;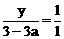 ,解得y=3-3a。
,解得y=3-3a。
通过上述可知,平衡时B的物质的量为(3-3a)mol,由于该反应起始时投放的物质为A、B、C均有,即从中间状态开始达到平衡,故平衡可能向左、向右或不移动,也即3a可能大于、小于或等于1(不移动时,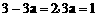 ),故(3)中B的物质的量应为(丁)。
),故(3)中B的物质的量应为(丁)。
(4)在(3)的平衡中,再加入3mol C,所达到的平衡状态与(1)、(2)、(3)皆为等效状态,通过(1)可求出C的物质的量分数为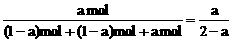 ,也就是在(3)的平衡状态时C的物质的量分数。
,也就是在(3)的平衡状态时C的物质的量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com