
题目列表(包括答案和解析)
2.下列物质中,属于弱电解质的是
A.CH3COOH B.H2SO4 C.NaOH D.Na2CO3
1. 食物的选择与其酸碱性关系很大。下列食物中,属于酸性食物的是
食物的选择与其酸碱性关系很大。下列食物中,属于酸性食物的是
A.柠檬 B.黄瓜 C.萝卜 D.鸡蛋
19.(6分)一氧化碳与水蒸气的反应为
 CO(g) + H2O(g)
CO(g) + H2O(g)  CO2(g) + H2(g)
在密闭容器中,将1.0 mol CO与1.0mol H2O混合
CO2(g) + H2(g)
在密闭容器中,将1.0 mol CO与1.0mol H2O混合
加热到434℃,在434℃的平衡常数K1 =9
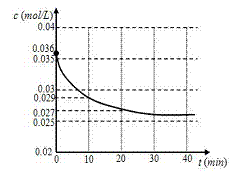
(1)跟踪测定H2O的物质的量浓度,如图所示,
则0 -20 min ,H2O的反应速率是
(2)请在图中用实线绘制出在该温度下加入正催化
剂后,H2O的物质的量浓度变化图线。
(3)从434℃升温至800℃,800℃的平衡常数K2 =1,则正反应为_____________(填“放
热反应”或“吸热反应”或“不能确定”)。 (4)求在800℃反应达平衡时,CO转化为CO2的转化率(写出必要的计算过程)
北京市延庆县2010届高三上学期期末检测
18. (13分)氨是最重要的氮肥原料。在课本里学到的合成氨技术
(13分)氨是最重要的氮肥原料。在课本里学到的合成氨技术
叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。
然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在
常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的
电解池(如右图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式: ;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质? (填“能”、“不能”)
为什么?
(3)电解池中,阳极发生 (填得或失)电子氧化反应,变价元素化合价 (填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极: ;阴极___________________________
总反应式:__________________________________。
17.(8分)1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:NH3+CO2+H2O NH4HCO3 ;
 NH4HCO3+NaCl
NH4HCO3+NaCl
NaHCO3↓+NH4Cl ; 2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因 (选填字母)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按设计的方案进行实验。将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图
中夹持、固定用的仪器未画出)。请回答:

①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):
16.(18分)芳香族化合物在生产生活中有广泛的用途。
 Ⅰ。实验室一试剂瓶标签严重破损,只能隐约看到一部分:
Ⅰ。实验室一试剂瓶标签严重破损,只能隐约看到一部分:
取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物
质完全燃烧得到39.6g CO2 与9g H2O。
(1)通过计算可知该有机物的分子式为: 。
(2)进一步实验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体。②16.6g 该物质与足量NaOH反应,消耗0.1mol NaOH。请写出一种符合该物质结构的结构简式:
|
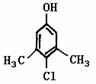
Ⅱ。滴露是一种常用消毒剂。它的主要成分结构如图1:
(1)它具有的官能团的名称:
(2)该分子在核磁共振氢谱图中显示出 种峰,
其峰面积比为
 (3)写出它与氢氧化钠溶液反应的化学方程式
(3)写出它与氢氧化钠溶液反应的化学方程式
 Ⅲ。多巴胺是在大脑的相应部位传递快乐信息化学物质,结构如图2:
Ⅲ。多巴胺是在大脑的相应部位传递快乐信息化学物质,结构如图2:
(1)多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得。合成过
程示如下:
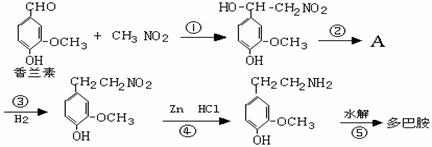
写出上述过程中①的反应类型:
写出②、⑤两步的化学方程式:
②:
⑤:
(2)写出香兰素的银镜反应的化学方程式
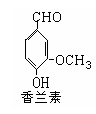 (3)写出符合下列条件的香兰素的所有同分异构体的结构简式:①苯环上有两个取代基,其苯环上的一溴代物有两种;②能发生水解反应;
③显弱酸性
(3)写出符合下列条件的香兰素的所有同分异构体的结构简式:①苯环上有两个取代基,其苯环上的一溴代物有两种;②能发生水解反应;
③显弱酸性
15.(13分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
|
10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4
+、OH- |
|
18电子粒子 |
H2S、HCl、K+ 、Cl- 、C2H6 …… |
(1)表中-1价的简单离子在周期表中的位置是 (周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为
(2)表中水溶液显碱性的分子的电子式是
写出其催化氧化的化学方程式
(3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式
。
(4)表中在水溶液中能够促进水电离的粒子有
(5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。

其中操作有错误的单元有(选填①②……)
(6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式
14.铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为
2CuFeS2+4O2 == Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为: 2Cu2S+3O2 == 2Cu2O+2SO2;2Cu2O+Cu2S == 6Cu+SO2↑;④电解精炼铜。下列说法不正确的是 ( )
A.Cu2O是红色固体
B.冶炼过程中的尾气可用来制硫酸
C.上述过程中,由2 mol CuFeS2制取Cu时,最少消耗5.0mol O2
D.电解精炼铜的开始阶段,每转移2mol电子时,阳极溶解铜的质量为64g

第Ⅱ卷(非选择题 共58分)
本卷共5小题,共58分。
13. 下列混合溶液中,各离子浓度的大小顺序正确的是
( )
下列混合溶液中,各离子浓度的大小顺序正确的是
( )
A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:
C(Cl-) > C(NH4+) > C(OH-) > C(H+)
B. 10mL0.1mol/L NH4Cl溶液与5mL0.2mol/L NaOH溶液混合:
C(Na+) = C(Cl-) > C(OH-) > C(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/L NaOH溶液混合:
C(Na+) = C(CH3COO-) > C(OH-) > C(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:
C(Cl-) > C(Na+) > C(OH-) > C(H+)
12.几种短周期元素部分性质的数据见下表:
|
元素性质 |
元素编号 |
|
① ② ③ ④ ⑤ ⑥ ⑦ |
|
|
原子半径 |
0.74 1.60 1.52 1.10 0.99 1.86 0.75 |
|
最高正化合价 |
无 +2 +1 +5 +7 +1 +5 |
|
最低负化合价 |
-2 无 无 -3 -1 无
-3 |
下列说法正确的是 ( )
A.③、⑥号元素都是金属元素
B.⑤的单质(M)与水反应的化学方程式为:2M + 2H2O= 2MOH + H2↑
C.⑥是该周期元素中原子半径最小的元素
D.①、⑥号元素只能形成一种白色化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com