
题目列表(包括答案和解析)
5.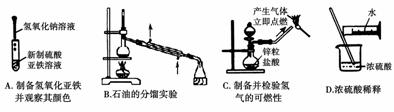 根据实验目的判断下列实验操作或装置正确的是
根据实验目的判断下列实验操作或装置正确的是
4.出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法不正确的是
A.锡青铜的熔点比纯铜低
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成的Cu2(OH)3Cl俗名为铜绿
3.下列变化一定属于化学变化的是
①工业制O2 ②爆炸 ③缓慢氧化 ④品红褪色 ⑤无水硫酸铜由白变蓝 ⑥ 久置浓硝酸变黄
A.①②③ B.④⑤⑥ C.③⑤⑥ D.③④⑤
2.下列叙述,从化学角度分析正确的是
A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
B.绿色食品是指使用过化肥和农药生产出来的农副产品
C.加碘食盐中加入的I2有利于防止地方缺碘病。
D.在煤炭中加入生石灰可以减少SO2的排放,减少酸雨的发生
1.对汽车尾气的处理有人提出下列做法:在马路上铺设“光触媒”(如二氧化钛)物质,将空气中的氮氧化物、一氧化碳、二氧化硫等污染物在催化剂表面转化、分解成对人体、环境基本无害的物质。下列有关说法正确的是
A.此法可将汽车尾气中的CO在催化剂表面氧化生成CO2
B.此法可将汽车尾气中的NOx在催化剂表面氧化生成N2
C.此法可将汽车尾气中的二氧化硫还原成三氧化硫
D.此法是解决城市空气污染的唯一途径
21.(10分)已知反应① 的平衡常数为K
的平衡常数为K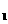 ,反应②
,反应②
 ,的平衡常数为
,的平衡常数为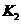 ,回答下列各小题。
,回答下列各小题。
 (1)反应①的平衡常数K
(1)反应①的平衡常数K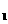 的表达式为
。
的表达式为
。
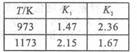
(2)在不同温度下,K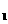 和K
和K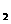 的值如右表所示。现有反应③:
的值如右表所示。现有反应③:
 这是一个 (填“吸热”
这是一个 (填“吸热”
或“放热”)反应。要使反应③在一定条件下建立的平衡向右移动,可采取的措施为 (填字母代号)。
A.缩小容器体积 B.扩大容器体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(3)利用下列试剂和用品,设计一个实验说明把CO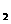 溶于水所得到的溶液是一种弱酸,你所
溶于水所得到的溶液是一种弱酸,你所
选用的试剂为 (填字母代号),能得出该结论的现象为 。
A.饱和CO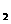 溶液 B.饱和碳酸钠溶液
溶液 B.饱和碳酸钠溶液
C.石蕊试液 D.pH试纸
(4)已知饱和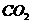 溶液中
溶液中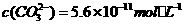 ,
,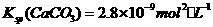 向1.0mol·L
向1.0mol·L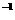 的CaCl2溶液中通入
的CaCl2溶液中通入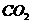 气体直至饱和,能否得到CaCO
气体直至饱和,能否得到CaCO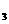 沉淀? ,理论依据是
。
沉淀? ,理论依据是
。

20.(11分)运用化学反应原理研究以下问题:
(1)合成氨反应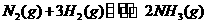 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)在25℃时,向浓度均为0.1mol·L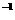 的MgCl
的MgCl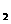 和CuCl
和CuCl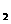 混合溶液中逐滴加入氨水,先生成
沉淀(填化学式),生成该沉淀的离子方程式为
。
混合溶液中逐滴加入氨水,先生成
沉淀(填化学式),生成该沉淀的离子方程式为
。
(已知25°C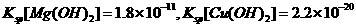
(3)在25°C时,将amol·L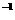 的氨水与0.0lmol·L
的氨水与0.0lmol·L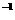 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中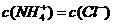 ,则溶液显 性(填“酸”、“碱”或“中”);且
,则溶液显 性(填“酸”、“碱”或“中”);且 =
0.01(填
=
0.01(填
“>"、“=”或“<”)。
19.(11分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是过渡元素且为地壳中含量较多的金属元素之一。请回答下列问题:
(1)化合物M的结构简式为 。
(2)在元素周期表中,E元素位于第 周期第 族。写出E元素的核外电子排
布式: 。
(3)元素C与D的第一电离能的大小关系是C D(填“>”、“<”或“=”)。
(4)CA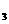 分子空间构型为
;CA
分子空间构型为
;CA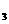 分子里共价键的类型是
。
分子里共价键的类型是
。
(5)甲同学用图1所示装置对E元素单质与浓硫酸的反应进行实验。①检查装置气密性后,
将过量的E元素单质和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时。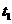 时开始加热,
时开始加热,
在单质表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集
到的气体体积与时间的关系粗略地表示为图2。

在0-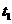 时间段,铁屑表面没有气泡生成,说明铁在浓硫酸中发生了 ;
时间段,铁屑表面没有气泡生成,说明铁在浓硫酸中发生了 ;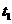 ~
~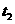 时间
时间
段,反应生成的气体是 。写出开始加热时发生反应的化学方程式:
。
18.(10分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、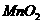 、S,设计了以下实验流程图:
、S,设计了以下实验流程图:
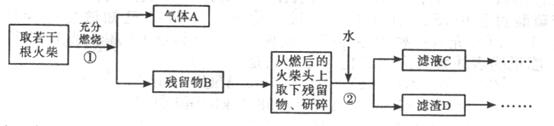
 请回答以下问题:
请回答以下问题:
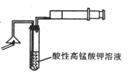
(1)为验证气体A,按右图所示进行实验:若能观察到
的现象,即可证明火柴头上含有硫单质。
(2)写出步骤①中发生反应的化学方程式: ,
。
(3)若步骤②所得滤液C浑浊,造成此结果的不当操作可能是(任写两点):
, 。处理措施是: 。
(4)要证明火柴头中含有Cl元素的后续实验步骤是
。
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5
次实验。
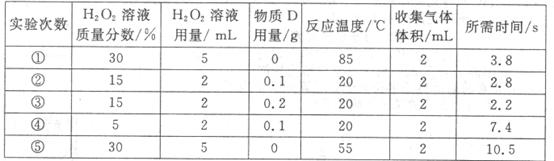
由上表可知,实验 和 证明温度越高,化学反应速率越快;实验 和
证明物质D的用量越大,反应速率越快。
17.(10分)水煤气(主要成分CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得,已知:
①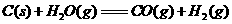
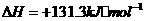
②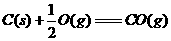
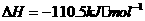
③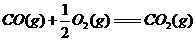
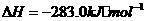
④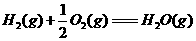
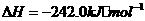
⑤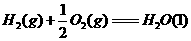

⑥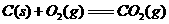
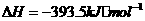
请回答下列问题:
(1)甲同学比较反应热数据1mol CO(g)和lmol H2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多,据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”的结论。请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”),判断的依据是
。
(2)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇(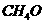 );②甲醛(CH2O);③甲酸(
);②甲醛(CH2O);③甲酸(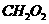 );④乙酸(
);④乙酸(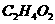 )。试分析当
)。试分析当
CO和Hz按1:1的体积比混合反应,合成上述 (填序号)物质时,可以满足“绿色
化学”的要求,完全利用原料中的原子,实现零排放。
(3)由CO、H2在一定条件下获得汽油的替代品--甲醇,已知: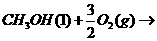
 (1)
(1)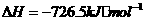 ,结合上述关系式试写出由
,结合上述关系式试写出由 、
、 生成甲醇的热化学方程式:
。
生成甲醇的热化学方程式:
。
(4)摩托罗拉公司开发的一种以甲醇为原料,以KOH溶液为电解质溶液的高效燃料电池。
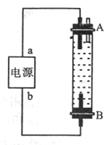 该电池放电时,负极电极反应式为
。
该电池放电时,负极电极反应式为
。
(5)某同学设计了一种以甲醇燃料电池为电源,用电解法制取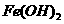 的
的
实验装置(如右图),通电后,溶液中产生大量的白色沉淀且较长时间不变
色,下列说法中不正确的是( )
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解质溶液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是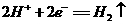
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com