
题目列表(包括答案和解析)
5.下列各组离子一定能大量共存的是
A.在碳酸氢钠溶液中:Na+、K+、AlO2-、CO32-
B、在水电离出的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Na+、S2-、AlO2-、
C.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SO42-
D.使pH试纸变红的溶液:Na+、Mg2+、NO3-、I-
4.在一密闭容器中有甲醛、氧气、氢气共16.5g,用电火花引燃,使其完全燃烧,再将燃
烧后的气体用Na2O2充分吸收,Na2O2增重8.5g,则原混合气体中O2的物质的量是
A.0.25 mol B.0.50mol C.0.27 mol D.0.52 mol
3. 短周期元素X、Y的原子序数相差2,下列叙述正确的是
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
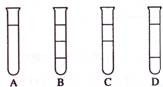
2.将等体积的三氯甲烷、四氯化碳和水在试管中充分混合后静置。下列图示现象正确的是
1.设NA为阿伏加德罗常数的数值,下列说法错误的是
A.标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA
B.0.1 molFe在0.1 mol Cl2中充分燃烧,转移的电子数为0.2NA
C.24 g NaH中阴离子所含电子总数为2NA
D. Fe(OH)3胶体带正电荷,电泳时会向阴极迁移
30. (8分) 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l
、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(8分) 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l
、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为
24. .某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积
.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积 变化的曲线如右图所示。据图判断正确的是( )21世纪
变化的曲线如右图所示。据图判断正确的是( )21世纪
 A.Ⅱ为盐酸稀释时pH值变化曲线高.考.资.源.网
A.Ⅱ为盐酸稀释时pH值变化曲线高.考.资.源.网
 B. b点溶液的导电性比c点溶液的导电性强高.考.资.源.网
B. b点溶液的导电性比c点溶液的导电性强高.考.资.源.网
 C. a点KW的数值比c点KW的数值大高.考.资.源.网
C. a点KW的数值比c点KW的数值大高.考.资.源.网
 D. b点酸的总浓度大于a点酸的总浓度高.考.资.源.网
D. b点酸的总浓度大于a点酸的总浓度高.考.资.源.网
第II卷非选择题(共52分)
二:填空题(3小题, 计24分 )
25:(8分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己、庚七种物质之间的相互反应关系如图:

(1)画出C元素原子核外电子排布式___ __ ____,戊的电子式_________。
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________ ________;
丙溶液呈碱性的原因_________ ___ 。
(3)写出有关反应①②③的离子方程式:
① ;
② ;
③ 。
26:(6分)某无色溶液,可能由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干中组成。取该溶液进行以下反应:
 ⑴取适量试液,加入过量盐酸,有气体生成,并得到溶液; Blog/?UserId=997609
⑴取适量试液,加入过量盐酸,有气体生成,并得到溶液; Blog/?UserId=997609
 ⑵在⑴所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
⑵在⑴所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
 ⑶在⑵所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
⑶在⑵所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
 (1)溶液中一定不存在的离子是______________________________________________;
(1)溶液中一定不存在的离子是______________________________________________;
 (2)一定存在的离子是____________________________________________________;
(2)一定存在的离子是____________________________________________________;
 (3)判断沉淀乙成份的方法是______________________________________________。
(3)判断沉淀乙成份的方法是______________________________________________。
 27:(10分)硅单质及其化合物应用范围很广。
27:(10分)硅单质及其化合物应用范围很广。
 ( l )制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
( l )制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
 I.高温下用碳还原二氧化硅制得粗硅
I.高温下用碳还原二氧化硅制得粗硅
 II.粗硅与干燥的氯气在450℃
~ 500℃ 反应制得SiCl4
II.粗硅与干燥的氯气在450℃
~ 500℃ 反应制得SiCl4
 III.SiCl4
液体经精馏提纯后与过量H2在1100℃~1200℃
反应制得纯硅
III.SiCl4
液体经精馏提纯后与过量H2在1100℃~1200℃
反应制得纯硅
 已知SiCl4沸点为57
. 6 ℃ ,能与H2O 强烈反应。1
molH2与SiCl4 气体完全反应吸收的热量为120
. 2kJ 。请回答下列问题:
已知SiCl4沸点为57
. 6 ℃ ,能与H2O 强烈反应。1
molH2与SiCl4 气体完全反应吸收的热量为120
. 2kJ 。请回答下列问题:
 ① 第I
步制备粗硅的化学反应方程式为____________________________________。
第III
步反应的热化学方程式是___________________________________________。
① 第I
步制备粗硅的化学反应方程式为____________________________________。
第III
步反应的热化学方程式是___________________________________________。
 ② 整个制备纯硅过程必须严格控制无水无氧。SiCl4
在潮湿的空气中因水解而产生白色烟雾,其生成物是______________________
; H2还原SiCl4 过程中若混O2
,可能引起的后果是______________________________。
② 整个制备纯硅过程必须严格控制无水无氧。SiCl4
在潮湿的空气中因水解而产生白色烟雾,其生成物是______________________
; H2还原SiCl4 过程中若混O2
,可能引起的后果是______________________________。
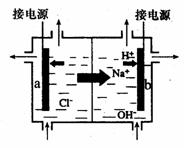
 ③ 上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如下图所示),其中进人阳极室的溶液是_____________________
, b 电极上的电极反应式是__________________________。
③ 上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如下图所示),其中进人阳极室的溶液是_____________________
, b 电极上的电极反应式是__________________________。

 ( 2 )二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3
和CaCO3
共283kg
在高温下完全反应时放出CO2
44kg ,生产出的玻璃可用化学式Na2SiO3
· CaSiO3 · xSiO2表示,则其中x
= __________________________。
( 2 )二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3
和CaCO3
共283kg
在高温下完全反应时放出CO2
44kg ,生产出的玻璃可用化学式Na2SiO3
· CaSiO3 · xSiO2表示,则其中x
= __________________________。
 三:实验题(2小题,计20分)
三:实验题(2小题,计20分)
 28:(6分)试回答下列问题
28:(6分)试回答下列问题
 (1)下列实验中所选用的仪器或操作以及结论不合理的是
。
(1)下列实验中所选用的仪器或操作以及结论不合理的是
。
 A、用托盘天平称量11.7g氯化钠晶体
A、用托盘天平称量11.7g氯化钠晶体
 B、用碱式滴定管量取25.00mL高锰酸钾溶液
B、用碱式滴定管量取25.00mL高锰酸钾溶液
 C、不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
C、不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
 D、测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
D、测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
 E、用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH2COOH溶液
E、用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH2COOH溶液
 F、量筒内液体体积正确读数为10.0mL时,全部倒入烧杯内的实际体积10.0mL
F、量筒内液体体积正确读数为10.0mL时,全部倒入烧杯内的实际体积10.0mL
 G、100mL容量瓶内液面正好达到刻度线,全部倒入烧杯内的实际体积小于100mL
G、100mL容量瓶内液面正好达到刻度线,全部倒入烧杯内的实际体积小于100mL
 (2)欲量取20.00mLNa2CO3溶液,应选用的仪器是
。
(2)欲量取20.00mLNa2CO3溶液,应选用的仪器是
。
 (3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
、
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
、
 29:(14分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
29:(14分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

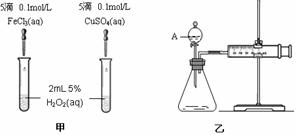
 (1)定性分析:如图甲可通过观察
,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是
(1)定性分析:如图甲可通过观察
,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是
,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
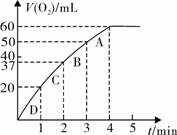 (3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③放出 气体所需时间为 min。
气体所需时间为 min。
④反应放出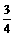 气体所需时间约为
min。
气体所需时间约为
min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因 。
⑦计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
四:推断题(8分)
23.下列推断合理的是( )高.考.资.源.网
 A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂高 .考.资.源.网
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂高 .考.资.源.网
 B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
高.考.资.源.网
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
高.考.资.源.网
 C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
高.考.资.源.网
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
高.考.资.源.网

 D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色高.考.资.源.网
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色高.考.资.源.网
22.下列关于氯的说法正确的是( )高.考.资.源.网
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂高.考.资.源.网
B.若1735Cl、1737Cl为不同的核素,有不同的化学性质高.考.资.源.网
C.实验室制备Cl2,可用排饱和食盐水集气法收集 高.考.资.源.网
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
21.. 在下列给定条件的溶液中,一定能大量共存的离子组是( )
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液: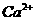 、H+、
、H+、 、
、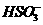
B.能使pH试纸呈红色的溶液:Na+、NH+4、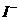 、
、
C.FeCl2溶液:K+、Na+、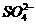 、
、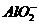
D.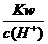 =0.1 mol/L的溶液:Na+、K+、
=0.1 mol/L的溶液:Na+、K+、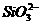 、
、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com