
题目列表(包括答案和解析)
4.某有机混合物4.6g完全燃烧,将燃烧后的混合物通入过量的澄清石灰水,石灰水共增重14.2g,经过滤得到20g沉淀。该有机样品可能是
A.C2H6O2 B.CH4和C2H6的混合物
C.C2H6O和C3H8O3的混合物 D.CH4O和C3H8O的混合物
3.根据元素周期表和元素周期律分析下面的推断,下列说法中错误的是
A.Be的原子失电子能力比镁弱 B. At不能在常温下与氢气反应
C.H2Se比H2S稳定 D. Sr(OH)2比Ca(OH)2的碱性强
2.在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同。试根据甲、乙的密度(ρ)的关系,下列说法中正确的是
A.若ρ(甲)>ρ(乙),则气体体积:甲<乙
B.若ρ(甲)>ρ(乙),则分子数:甲>乙
C.若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙
D.若ρ(甲)<ρ(乙),则气体的压强:甲>乙
1.下列说法中错误的是
A.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
B.游离态的硫可存在于火山喷口附近
C.葡萄糖可用于食品加工、医疗输液、合成补钙药物及维生素C等
D.福尔马林溶液具有杀菌、防腐性能,可用于海鲜类食品的防腐
21.下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
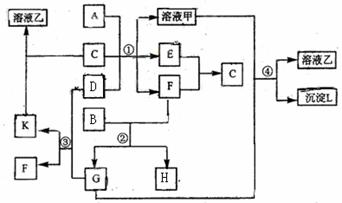
(1)A、D代表的物质分别为 、 (填名称);
并写出D的两个用途 ;
(2)反应①中的C、D均过量,则该反应的化学方程式是 ;
同时 写出反应④的离子方程式为 。
(3)反应②中,若B与F物质的量之比为5∶4,则反应②的化学方程式为
20.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),
反应中得到的氧化产物是
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3。 d.用浓硫酸吸收 e.用氨水吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,
可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程。 、 。(此处离子方程式可不配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。
方法为:
①用稀盐酸浸取炉渣,过滤。过滤所用的玻璃仪器是
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.检验沉淀是否洗涤干净的方法是
b.滤液先氧化,选取的氧化剂最好是: (只要求一种)
提供的试剂: KSCN溶液、 稀硝酸、 稀盐酸、 碘水、 稀硫酸 、 KMnO4溶液 、 NaOH溶液、双氧水。
c.炉渣中AI2O3除去的离子方程式是 。
19.某同学为了测定三聚氰胺的分子式和结构简式,设计了如下实验:
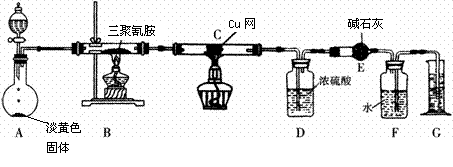
查阅资料:三聚氰胺的相对分子质量为126,三聚氰胺在常温下呈晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。取12.6 g的三聚氰胺晶体按如图装置进行实验(假设三聚氰胺完全反应转化成产物)。
(1)写出A装置中发生反应的化学方程式
(2)D装置能不能与E装置互换?为什么? ;
(3)当B装置中反应完全发生后,读取G中水的体积的实验操作顺序为 (填序号);
①读数 ②冷却至室温 ③调平F、G装置中的液面
(4)测定数据如下:
|
装置 |
D |
E |
|
实验前 |
101.9 g |
55.8 g |
|
实验后 |
107.3 g |
69.0 g |
经测定,F中收集的气体折合标准状况下的体积为6720ml。
已知在三聚氰胺分子中存在类似于苯环结构的六元环,试写出三聚氰胺的结构简式 ;
18.取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间关系如图所示,试回答下列问题:
①原NaOH溶液的物质的量浓度为 。
②曲线A表明,原NaOH溶液中通入CO2后,
所得溶液中溶质的物质的量之比为 。
③曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
17.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
A(g) + xB(g)  2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率
随时间变化的关系如下图所示。 请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率
随时间变化的关系如下图所示。 请回答下列问题:
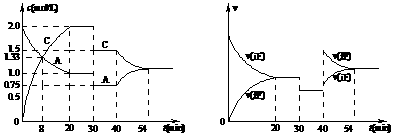
⑴30min时改变的条件是 。
⑵反应过程中B的转化率最大的时间段是 min。
⑶该反应的ΔH 0(填:“>”、“=”或“<”)。
⑷有甲、乙两个完全相同的容器,向甲容器中加入1 molA(g)和2x molB(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2molC(g) 和x molB(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中A的转化率为 。
16.X、Y、Z为短周期元素的单质,A、B为它们的化合物,这些物质之间的关系
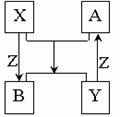 如下图所示,其中反应条件和某些产物已经略去:
如下图所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,
写出反应“A+X→B+Y”的化学反应方程式:
①若已知B 是水: ;
②若已知A、B均为氧化物 。
(2)如果X、Y的组成元素在不同主族,且X元素在自然界中
形成的化合物种类最多,分布极广,则A+X→B+Y化学方程式为____________。
(3)如果X、Y的组成元素在同一周期,则Z单质为__________(写名称)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com