
题目列表(包括答案和解析)
2.(共8分)(1) NaCl(2分)
(2)Na2SO3:0.06 mol(2分), NaCl:0.02 mol(2分);1.344 L(2分)
2.(8分)白色粉末A由Na2SO3、Na2SO4 和NaCl等物质中的二种或三种混合而成,取一定量A样品,投入100 mL 2.2 mol·L-1 盐酸中,充分反应后过滤,最终得到100 mL含H+ 的物质的量浓度为1 mol·L-1 的滤液。若将此滤液蒸干,只得到8.19g纯净物B。
(1)B的化学式 ;
(2)则所取的A样品中含有的各物质的物质的量分别为 ;该样品与投入的盐酸反应后生成气体的体积为(标准状况) 。
1.(5分)溶液中含有Fe2+:0.5mol/L×0.2L=0.1mol
设Fe2(SO4)3反应消耗铁的物质的量为x,与CuSO4反应消耗铁的物质的量为y
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu
1mol 1mol 3mol 1mol 1mol 1mol 1mol
xmol xmol 3xmol ymol ymol ymol ymol
可得:3x+y=0.1mol 6g-56x+8y=5.2g
解得x=0.02mol y=0.04mol
故得:生成铜质量为0.04mol×64g/mol=2.56g
原溶液中Fe2(SO4)3的物质的量浓度为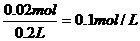
答:(1)反应后生成铜的质量为2.56g。(2)原溶液中Fe2(SO4)3的物质的量浓度为0.1mol/L。
1.(5分)将6g的铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL、0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算:
(1)反应后生成铜的质量;
(2)原溶液中Fe2(SO4)3的物质的量浓度。
32.(10分)(1)放热 …………………………………………………………………2分
(2)乙 ………………………………………………………………………2分
(3)蒸馏 ……………………………………………………………………2分
(4)向混合液中加氢氧化钠溶液调pH至弱碱性,加入新制的氢氧化铜,加热 ………………………………………………………………2分
(5)氮气 ……………………………………………………………………2分
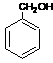
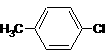
31.(8分)(1)CH3CHO ……………………………………………………………2分
|
|
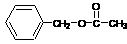
|


|
 (3)3 ……………………………………………………………………………2分
(3)3 ……………………………………………………………………………2分
…………………………………………………………2分
1.5×10-3mol·L-1·s-1 …………………………………………………2分
(3)b c …………………………………………………………………2分
(4) 2NO(g)+O2(g) 2NO2(g) ΔH= -112.6 kJ
………………2分
2NO2(g) ΔH= -112.6 kJ
………………2分
(5)c …………………………………………………………………2分
30.(12分) (1)K=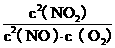 ………………………………………2分
………………………………………2分
(2)b …………………………………………………………………2分
29.(8分)(1)Cl2 …………………………………………………………………1分
2 ……………………………………………………………………1分
(2)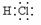 ……………………………………………………………1分
……………………………………………………………1分
非极性 ……………………………………………………………………1分
(3)S>Cl ……………………………………………………………1分
三 ……………………………………………………………………1分
IA ……………………………………………………………………1分
(4)a b ……………………………………………………………………1分
28.(4分) (1)Na …………………………………………………………………1分
强 …………………………………………………………………1分
(2) ③ …………………………………………………………………1分
(3)4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ……………………………… 1分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com