
题目列表(包括答案和解析)
7.将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克。
则
(1)剩余固体是 (化学式),
(2)原混合物中Na2CO3的物质的量是 mol。
(3)已知Na2CO3和稀盐酸反应分两步进行:
Na2CO3+HC1→NaC1+NaHCO, NaHCO3+HC1→NaC1+CO2↑+H2O,若将上述19g混合物溶于适量的水中配成溶液,在该溶液中逐滴加入1mol/L的稀盐酸,用消耗的盐酸体积(mL)作为横坐标,反应产生的CO2的体积作为纵坐标得到如下图像:
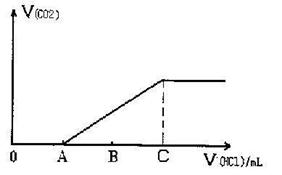
求:A点对应溶液的溶质是 (填化学式);C点时消耗盐酸的体积是 mL。C点时产生的CO2的体积在标况下是 L。
6.
(1)CO2+Ca(OH)2=CaCO3↓+H2O(2分)
(2)0.74g(2分)
(3)896mL(2分)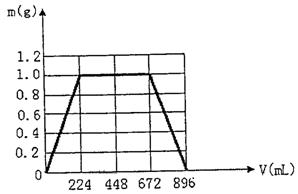
(4)(2分)
6.将KOH和Ca(OH)2混合物1.86 g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同。)
(1)生成沉淀的质量刚好最大时,反应的离子方程式为:
。
(2)原混合物中Ca(OH)2的质量为 g。
(3)沉淀恰好溶解时,消耗CO2的体积为 mL。
(4)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。

5.(1)12.4g (2)49.18g
5.锈铁片(铁锈为氧化铁)置于稀硝酸中,反应结束后收集到1.12LNO(标准状况),溶
液中还剩下4g单质铁。取出铁后,向溶液中通入10.65gCl2,恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+反应)。计算:
(1)锈铁片中铁单质的质量。
(2)锈铁片中铁锈的质量分数。
4.(每空2分,共10分)
(1)1
(2)否;逆
(3)2,50%
7.5×10-3mol·L-1。
(1)计算800℃,1.0×105Pa条件下,上述反应的平衡常数K= 。
(2)800℃,1.0×105Pa条件下,起始时在上述容器中加入1molCI、1molH2O、2molH2、2molCO2,则此反应的初始状态 (填“是”、“否”)为平衡状态;若是平衡状态不必做答,若不是平衡状态,反应将向 (填“正”、“逆”)反应方向进行以达到化学平衡状态。
(3)在800℃,1.0×105Pa条件下,将4molCO和4molH2O投入密闭容器中进行上述反应,达到平衡后,H2的物质的量为a mol,CO的转化率为α,则a= ,α= 。
4.(10分)在800℃密闭容器中进行反应:
 CO(g)+H2O(g) CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为
CO(g)+H2O(g) CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为
3.(9分)(1)H++OH-=H2O(1分) NH4++OH- NH3↑+H2O(1分)
NH3↑+H2O(1分)
(2)0.84(2分) (3)1:4 (2分)
(4)Ⅲ(1分) 5 mol·L-1 (2分)
3.(9分)为测定(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同物质的量浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4固体分解的温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量(g) |
NaOH溶液的体积(mL) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中发生的有关反应的离子方程式为
;
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为 L;
(3)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 ;
(4)欲计算该NaOH溶液的物质的量浓度,应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com