
题目列表(包括答案和解析)
3.下列各组离子在指定溶液中能大量共存的是:
①无色溶液中:K+、Cu2+、Na+、MnO4-、、SO42-
②pH=11的溶液中:CO32-、Na+、A1O2-、NO3-
③加入Al能放出H2的溶液中:C1-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、C1-、I-
⑤能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、C1-
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
2. 工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充水,也无多余的水分,所用硫酸溶液溶质的质量分数应为:
A.45.8% B.57.6% C.72.3% D.无法确定
1.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是:
①根据酸分子中含有的氢原子数将酸分为一元酸、二元酸等,②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应,③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液,④根据反应中的热效应将化学反应分为放热反应和吸热反应。
A.①③ B.②④ C.①②④ D.②③④
10.(每空3分,共6分)1mol·L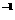 ;3mol·L
;3mol·L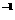
10.(6分)将一块金属钠投入到100mLMgCl3和AlCl3的混合溶液中,发现沉淀先多后少。 反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。
则原溶液中Mg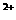 的物质的量浓度为 ;Al
的物质的量浓度为 ;Al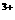 的物质的量浓度为 。
的物质的量浓度为 。
9、
(1)5:2(3分)
(2)7mol/l(2分)
(3)1:3(3分)
(4) 5Fe +14HN O3=Fe(NO3)2+NO2 +3NO+7 H2O (2分)
9、将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。
(2)求理论上原硝酸的物质的量浓度。
(3)求混合气体中NO2、NO的体积比。
(4)写出上述反应的总的化学方程式。
8.(1)0.8mol/L (2)29.6%
8.白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙3份质量不同的A样品分别与50.0mL 相同浓度的盐酸充分反应,得到气体的体积(标准状况)与A的质量关系如下表:
|
实验组别 |
甲 |
乙 |
丙 |
|
稀盐酸的体积(mL) |
50.0 |
50.0 |
50.0 |
|
A样品的质量(g) |
2.84 |
5.25 |
7.00 |
|
气体的体积(L) |
0.672 |
0.896 |
0.896 |
试计算:(1) 该盐酸的物质的量浓度。
(2) 混合物中NaHCO3的质量分数。
7.(1)Na2CO3
(2)0.1 NaC1 NaHCO3
(3)300 4.48L(每空1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com