
题目列表(包括答案和解析)
34.(10分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
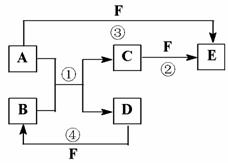
(1)若A、D、F都是短周期的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则B的名称是 ,所属晶体类型为 。
(2)若A是常见的可变价金属单质,B是强电解质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 。已知1 g D与足量的F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式
(3)若A、D为短周期元素的单质,且所含元素的原子序数A是D的2倍,最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体产生,则B的结构式为______________,F为______________(填名称)的浓溶液。
33. (15分)下图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
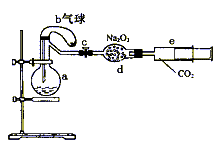
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是 。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施,若用加入化学试剂法,下列试剂中可以使用的是(填代号) 。
A.蒸馏水 B.无水醋酸钠 C.石墨 D.硝酸银(少量)
(3)将烧瓶充分振荡,所观察到的现象是 ;
有关反应的化学方程式是 。
(4)打开弹簧夹c,将二氧化碳推入干燥管内,使反应充分进行。将烧瓶中反应的全过程用一个总的化学方程式表示:
(5)欲使所有的铜粉都溶解,至少需要推入二氧化碳 mL(设推入的二氧化碳全部反应)。
32. (12分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期元素组成的单质中熔点最高的金属,K是一种气体。
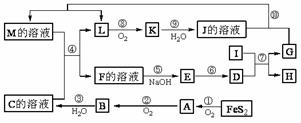
请填写下列空白:
(1)在周期表中,组成G的元素位于第______周期第______族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是 (填写序号)。
(4)反应④的离子方程式是: 。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是: 。
30.NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是:
A.分子中不含有H原子的分子是非极性分子
B.在ABn分子中A原子的所有价电子都参与成键的是非极性分子
C. ABn分子中每个共价键的键长都相等的分子不一定是非极性分子
D.在ABn分子中A的相对原子质量小于B的相对原子质量时为非极性分子
二卷(共50分)
三、非选择题
31.(13分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为9。又知B、D、E分别与A、C两元素形成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1molM中含有42mol电子。回答下列问题:
(1)元素C在周期表中的位置是 ;
(2)化合物M中含有的化学键类型有 ;
(3)写出化合物Y与Z之间反应的离子方程式 ;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则正极上的电极反应式为 。
(5)A、B、C、D、E五种元素对应的常见简单离子的半径大小顺序为: (注意表达)
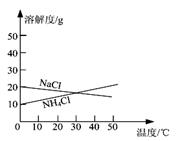
29.联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl
|
选项 |
通入气体 |
温度控制 |
|
A |
CO2 |
30 ~ 40℃ |
|
B |
CO2 |
0 ~ 10℃ |
|
C |
NH3 |
30 ~ 40℃ |
|
D |
NH3 |
0 ~ 10℃ |
和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是:
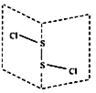
28.二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红溶液褪色的气体。下列说法中错误的是:
 A.S2Cl2的电子式为:
A.S2Cl2的电子式为: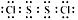
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O==SO2十3S↓十4HCl
27.某恒温恒容的容器中,建立如下平衡:2M(g) N(g),在相同条件下,若分别向容器中通入一定量的M或N,重新达到平衡后,容器内M的体积分数比原平衡时相比:
N(g),在相同条件下,若分别向容器中通入一定量的M或N,重新达到平衡后,容器内M的体积分数比原平衡时相比:
A.都减小 B.都增大 C.前者增大后者减小 D.前者减小后者增大
26.镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2= Mg2++2H2O。关于该电池说法正确的是:
A.镁合金为电源负极,发生氧化反应
B.放电时H+在正极反应得电子
C.正极方程式为:H2O2+2e-=2OH-
D.放电时正极的pH降低
25.某混合气体,可能含有N2、HCl、CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化,再通过足量的Na2O2固体,气体体积减小,最后通过灼热的铜网,经充分反应后,气体体积又减小,但还有剩余气体,以下对混合气体组成的判断正确的是:
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl、CO
C.一定有N2,CO和HC1中至少有一种
D.一定有N2和HCl,没有CO
24.长期以来,人们一直认为氟的含氧酸不可能存在,但是自1971年两位美国科学家斯图查尔和阿佩里曼成功地合成次氟酸后,这种观点强烈地动摇了。他们在0℃以下将氟从细冰上面通过,得到了毫克量的次氟酸。已知次氟酸的分子组成与次氯酸相似,且次氟酸与热水剧烈反应,生成既有氧化性又有还原性的物质的溶液。则下列说法中不正确的是:
A.次氟酸分子中原子间以共价键相结合
B.次氟酸见光会分解产生氟气
C.次氟酸与热水反应可能有H2O2生成
D.次氟酸中的氧与次氯酸中的氧化合价相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com