
题目列表(包括答案和解析)
1.不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定为世界上最小的温度计。研究人员在长约10-6m,直径为10-7m的碳纳米管中充入液态的金属镓。当温度升高时,管中镓就会膨胀,通过电子显微镜就能读取温度值。这种温度计测量的范围可从18℃到490℃,精确度较高,所以它可用于检查电子线路是否异常,测量定毛细血管的温度等许多方面。根据以上信息判断下列推测中不正确的是
A.碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计
B.金属镓的体积在10℃至500℃之间随温度变化很小,可忽略不计
C.金属镓的体积在30℃至500℃之间随温度变化比较均匀
D.金属镓的熔点很低,沸点很高
19.(16分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如右图所示。
Ⅱ.中和热的测定:
 (3)从实验过程来看,右图中尚缺少的两种玻璃仪器是 __、________;
(3)从实验过程来看,右图中尚缺少的两种玻璃仪器是 __、________;
由图可知该装置有不妥之处,应如何改正? _____
________________________________________________________________;
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
|
② 近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c = 4.18 J/(g·℃)。则中和热△H = (取小数点后一位)。
③ 上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.配制0.50 mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30 mL 0.50 mol/L的硫酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热的数值会 (填“相等”或“不相等”)。
18、(1 3分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B原子的最外层电子数之和与C原子的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物常温下均为液态。请回答下列问题(填空时用实际物质的化学式表示):
(1)、 写出A、D两种元素组成的化合物的电子式___________、 ;
 (2) 、B与D一般情况下可形成两种常见气态化合物,它们是______、________假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为
(2) 、B与D一般情况下可形成两种常见气态化合物,它们是______、________假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为
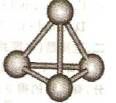
(3)、 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示,已知断裂lmolC-C吸收167kJ热量,生成1mo1C三C放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
① C4属于一种新型的化合物 ② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量 ④ C2与C4互为同素异形体
⑤ C4稳定性比P4(白磷)差 ⑥ C4与C2互为同分异构体
(4)已知 A2与C2一定条件下反应生成0.5moLAC3放出23kJ的热量,写出该反应的热化学方程式__________________________________。
(5)、 C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为 ,其空间构型为 。
(6) 、为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常加入氧化剂A2D2,发生反应的离子方程式为: _______________________
17.(10分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA,ⅢA族的连接处。请用相应的化学用语回答下列问题:

(1)d在元素周期表中的位置 ___ 、___________,该元素的名称是__________;
(2)写出由e元素形成的两种带有相同核电荷数的阴离子符号 、 。 (3)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 _____________________________。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的 极发生电极反应,电极反应式为 ________________________ 。
16.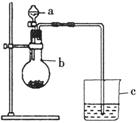 (5分)某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答:
(5分)某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答:
(1)仪器a的名称是 ,应盛放下列药品中的 。
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2)仪器b的名称是 ,应盛放下列药品中的 。
A.亚硫酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)如果观察到C中的现象为 ,即可证明硫与碳的非金属性的强弱。
15.下列说法正确的是 ( )
A.H与D、16O与18O互为同位素;H216O、D218O、T2O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在1个C2H5OH分子中,含有9个共价键
C.HBr的相对分子质量大于HF,所以HBr的沸点高于HF
D.由IA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子化合物
第 Ⅱ 卷
14.用二根铂丝作电极插入KOH溶液中,分别向两极通人甲烷和氧气,可作为一种燃料电池的模拟装置。试判断下列说法正确的是 ( )
A.通氧气的铂极为负极 B.此电池反应为CH4+2O2=CO2+2H2O
C.此电池放电时,KOH浓度减小 D.此电池放电时,KOH浓度不变
13.在溶液中能大量共存的一组离子或分子的是
A. 、
、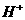 、
、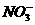 、
、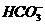 、
B.
、
B.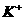
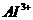 .
.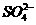 ,
,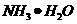
C.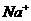 ,
,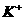 ,
,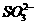
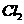 D.
D.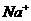 ,
,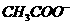 ,
,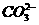 ,
,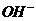
12. 下列离子方程式正确的是( )
A.过氧化钠和水反应:2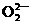 +2H2O=4OH-+O2↑
+2H2O=4OH-+O2↑
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
D.向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com