
题目列表(包括答案和解析)
21.(10分)DAP-A树脂是一种优良的热固性树脂,被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥;对环境及人员无损害;性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。这种材料可采用下列合成路线:
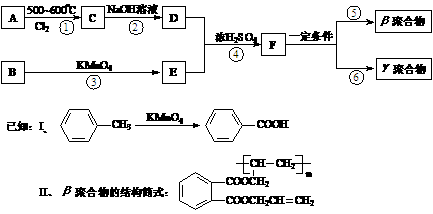
试回答下列问题:
(1)在①~④的反应中属取代反应的是 。
(2)写出反应②的化学方程式 。
(3)写出反应⑤的化学方程式 。
(4)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是 和 _____________。
20.(10分)已知SiO2 、SO2 和CO2 都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
Ⅰ.用如图所示装置进行Mg与SO2 反应的实验。
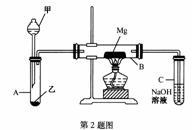 (1)选择制取SO2 的合适试剂___________
(1)选择制取SO2 的合适试剂___________
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④ CaSO3 固体
(2)写出装置B中发生的主要反应的化学方程式_____________。
(3)该装置还有不足之处,除在A和B之间缺少干燥装置外,还有一处是__________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si
②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自然
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(1)该小组“实验室制Si”的化学方程式是 。
(2)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是 。
19.(10分)如果取0.1 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8 。试回答下列问题:
(1)求出混合溶液中下列算式的精确计算结果:
c(Na+)一c(A-)= mol·L-1,c(OH-)一c(HA)= mol·L-1
(2)在含有A-、Na+、H+、OH-的水溶液中,如果出现下列关系请将它们在溶液中可能
对应的溶质分别填在横线上:
①c(Na+)>c(A-)>c(OH-)>c(H+):
②c(A-)>c(Na+)>c(H+)>c(OH-):
③c(Na+)>c(OH-)>c(A-)>c(H+):
18.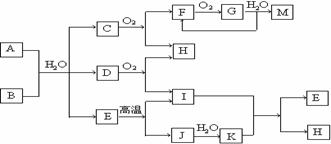 (12分)已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
(12分)已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
(1) 写出B的电子式 ,D的结构简式 ________。
(2) 写出A与B反应的化学方程式 。
(3) 如对气体G进行加压操作,产生的现象是 。
(4) 写出下列反应的离子方程式:
① 在A溶液中加入M 。
② 向A溶液中加入过量NaOH溶液,并加热 。
17.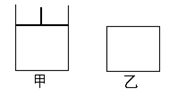 (12分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:
(12分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:
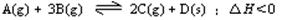
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变; B.2v正(C)=3v逆(B);
C.A、B转化率相等; D. 物质D的质量不随时间改变;
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时容器的体积为 mL,B的转化率α甲(B)为 。
(3)乙容器中反应达到平衡所需要的时间 ______2min(填“>”、“<”或“=”,下同),B的转化率α乙(B) ______α甲(B)。
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C) mol,加入D的物质的量n(D)应该满足的条件为 。
16.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
经由计算分析,下列推断正确的是
A.①中溶解了5.6 g Fe B.硝酸的浓度为4 mol/L
C.②中溶解了9.6 g Cu D.④中V = 6720
第Ⅱ卷
(本卷包括5小题,共54分)
15.向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,雅创教育网产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):
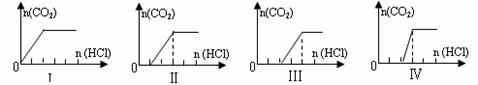
则下列分析都正确的组合是
|
|
溶液组成主要成分 |
对应图象 |
溶液中离子浓度关系 |
|
A |
NaHCO3 |
I |
c(Na+) = c(HCO3-) |
|
B |
NaHCO3、Na2CO3 |
Ⅱ |
c(CO32-) < c(HCO3-)雅创教育网 |
|
C |
NaOH、Na2CO3 |
Ⅲ |
c(OH-) > c(CO32-) |
|
D |
Na2CO3 |
Ⅳ |
c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) |
14.下列离子方程式中正确的是
A.FeBr2溶液中通入过量的Cl2 2Fe2++4Br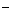 +3Cl2===2Fe3++2Br2+6Cl
+3Cl2===2Fe3++2Br2+6Cl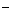
B.过量NaHSO4与Ba(OH)2溶液反应:Ba2++OH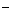 +H++SO
+H++SO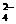 ===BaSO4↓+H2O
===BaSO4↓+H2O
C.漂白粉溶液中通入过量的SO2:ClO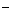 +SO2+H2O===HClO+HSO
+SO2+H2O===HClO+HSO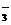
D.向FeI2溶液中通入Cl2至Fe2+恰好完全被氧化 2Fe2++Cl2===2Fe3++2Cl
13.已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.此酸的电离平衡常数约为1×10-7
C.升高温度,溶液的pH增大
D.由HA电离出的c(H+)约为水电离出的c(H+)的10-6倍
12.在一定温度下,反应H2(g)+X2(g)HX(g)的平衡常数为10,若将1.0 mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com