
题目列表(包括答案和解析)
24.答案:(1)取第②步后的上层清液1-2滴于点滴板上,再滴入1-2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量




 (2)Ca2++CO
(2)Ca2++CO CaCO3↓
CaCO3↓
 Ba2++CO
Ba2++CO BaCO3↓
BaCO3↓
(3)在此酸性条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
 (4)未用玻璃棒引流;未采用150 mL容量瓶
(4)未用玻璃棒引流;未采用150 mL容量瓶
解析:(1)鉴别SO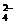 的特征试剂为含Ba2+的溶液,可取②步的上层清液再加BaCl2,看是否还产生沉淀来判断,若没有白色沉淀产生,则证明BaCl2已过量。
的特征试剂为含Ba2+的溶液,可取②步的上层清液再加BaCl2,看是否还产生沉淀来判断,若没有白色沉淀产生,则证明BaCl2已过量。
 (2)第④步的目的是为了除去Ca2+和过量的Ba2+,因此离子方程式应有Ca2++CO
(2)第④步的目的是为了除去Ca2+和过量的Ba2+,因此离子方程式应有Ca2++CO
 CaCO3↓,Ba2++CO
CaCO3↓,Ba2++CO BaCO3↓。
BaCO3↓。
(3)如果先加盐酸调pH值再过滤,可能使部分沉淀溶解,导致所得食盐不纯。
(4)配制一定物质的量浓度溶液时,要求所选容量瓶的容积应与待配制溶液的体积相等,即150 mL容量瓶;转移溶液时应用玻璃棒引流,而图中所示没有按要求做。
23. 答案:Ⅰ.(1)容量瓶
答案:Ⅰ.(1)容量瓶




 (2)2 5 6 2 8 502
(2)2 5 6 2 8 502
 (3)酸式
(3)酸式
 滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
 (4)
(4)
 (5)偏高
(5)偏高
 解析:(1)仪器的选用根据题意应该选用容量瓶。(2)残缺方程式配平首先确定缺什么,分析可知缺的是02,根据电子转移守恒,配平化学方程式。
解析:(1)仪器的选用根据题意应该选用容量瓶。(2)残缺方程式配平首先确定缺什么,分析可知缺的是02,根据电子转移守恒,配平化学方程式。

 (3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。(4)根据配平的化学方程式计算出过氧化氢的量,最后计算出原过氧化氢溶液中过氧化氢的质量分数为
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。(4)根据配平的化学方程式计算出过氧化氢的量,最后计算出原过氧化氢溶液中过氧化氢的质量分数为 。(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
。(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
 答案Ⅱ.(各1分,共4分)
答案Ⅱ.(各1分,共4分)
|
实验内容 |
实验方法 |
实验现象 |
|
验证氧化性 |
取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液。 过氧化氢溶液。 (取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液。) (取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液。) |
产生淡黄色沉淀或溶液变浑浊。 (溶液变蓝色。) (溶液变蓝色。) |
|
验证不稳定性 |
取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验。 用带火星的木条检验。 (取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中。) (取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中。) |
产生气泡,木条复燃。 (溶液变浑浊或有浅黄色沉淀产生) (溶液变浑浊或有浅黄色沉淀产生) |
 解析:(1)验证氧化性,选用具有还原性的饱和硫化氢溶液,产生淡黄色沉淀硫或溶液变浑浊;或者选用有还原性的碘化钾淀粉溶液,有碘单质生成,溶液变蓝色。(2)验证不稳定性,取适量过氧化氢溶液于试管中,加热,用带火星的木条检验有氧气生成;或者取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中,溶液变浑浊或有浅黄色沉淀产生。
解析:(1)验证氧化性,选用具有还原性的饱和硫化氢溶液,产生淡黄色沉淀硫或溶液变浑浊;或者选用有还原性的碘化钾淀粉溶液,有碘单质生成,溶液变蓝色。(2)验证不稳定性,取适量过氧化氢溶液于试管中,加热,用带火星的木条检验有氧气生成;或者取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中,溶液变浑浊或有浅黄色沉淀产生。
22. 答案:(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗) 在G和H之间增加干燥装置
答案:(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗) 在G和H之间增加干燥装置
 (2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
 2S+Cl2 S2Cl2
2S+Cl2 S2Cl2
(3)饱和食盐水(或水) 浓硫酸
(4)分液漏斗 蒸馏烧瓶 导气、冷凝
(5)产率降低 有固体产生(或其他正确描述)
 (6)SCl2 Cl2 S (任写其中两种即可)
(6)SCl2 Cl2 S (任写其中两种即可)
控制浓盐酸的滴速不要过快
解析:(1)A为带塞的分液漏斗,液体流入B中,导致A中上方压强小于B中上方压强,液体难于继续流入B中。若用导管将A的上口和B相连,则可解决上述问题。制备S2Cl2温度在110℃-140℃,S2Cl2成为气体,在G中又冷却为液体,但S2Cl2易与水反应,故应在G、H间加一个干燥装置。
(2)B中为实验室制Cl2的反应,E中为S和Cl2的反应。
(3)C为除去Cl2中HCl的装置,D为干燥氯气的装置。
(4)F为长导管,其作用为导气,冷凝S2Cl2。
(5)若温度过高,一部分S2Cl2又分解,导致产率降低。F中若部分S2Cl2与水反应生成S,则有固体产生。
(6)S2Cl2在生成过程中,S与Cl2均过量;温度过高S2Cl2又与Cl2反应生成SCl2,所以为了提高S2Cl2的纯度,除控制好温度外,还要控制Cl2的产生速率。
21.答案:




C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 澄清石灰水 检验CO2的存在。
解析:成套装置包括反应装置,检验装置和尾气处理装置。C中加入浓硫硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其它试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,最后再用装置A,放入澄清石灰水来检验CO2的存在,因SO2也可以使澄清石灰水变浑,故先要除去SO2。
20.答案:D
解析:A项中Ag+干扰;B项中HCO3-、SO32-、HSO3-干扰;C项中HCO3-、CO32-、HSO3-干扰;D想正确。
19.答案:B
解析:防止溶液倒吸是考试中的热点。A装置虽然能防止倒吸,但会有氯化氢逸入空气而造成环境污染。C、D装置中的进气管插入液面以下,不能起到防止倒吸的作用。
18.
 答案:D
答案:D
 解析:废酸与碱中和属于化学法,A项错;Cu2+不可能用SO42 -沉降,B项错;活性碳无法吸收苯,C项错;Na2CO3 + Ca(OH)2
解析:废酸与碱中和属于化学法,A项错;Cu2+不可能用SO42 -沉降,B项错;活性碳无法吸收苯,C项错;Na2CO3 + Ca(OH)2
 CaCO3↓+
2NaOH,是复分解法,属于化学法,D项正确。
CaCO3↓+
2NaOH,是复分解法,属于化学法,D项正确。
17.答案:B
解析:A项,乙醇不可以作为萃取剂,错;
B项,石蕊变蓝,则肯定为碱性,正确。
C项,若原溶液中含有SO32 -,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,故错;
D项,加热时,FeCl3会水解,错。
16.答案:D
解析:A.稀释浓H2SO4时应先在烧杯里加蒸馏水,再缓慢倒入浓H2SO4并不断搅拌;B.测定CuSO4·5H2O的结晶水含量,应先用天平称量空坩埚的质量,再加入晶体称量;C.检验酸性溶液中的Cl-和SO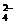 应先加Ba(NO3)2再加AgNO3;D.制取干燥纯净的Cl2时,先使Cl2通过水(或饱和食盐水)可除去其中混有的HCl。
应先加Ba(NO3)2再加AgNO3;D.制取干燥纯净的Cl2时,先使Cl2通过水(或饱和食盐水)可除去其中混有的HCl。
15.答案:D
解析:A项可用于分馏沸点不同的液体混合物;B项可以分离溶液和胶体;C项可用于过滤,从溶液中分离不溶物;而D项中能用于配制物质的量浓度溶液不能用于分离物质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com