
题目列表(包括答案和解析)
31. 120℃、101.3KPa条件下,有2LH2O、2LCO、1LCO2、0.5LO2和1LH2组成的混合气体。将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
120℃、101.3KPa条件下,有2LH2O、2LCO、1LCO2、0.5LO2和1LH2组成的混合气体。将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
 ⑴尾气是否有可能是单一气体? (填“可能”或“不可能”)。若可能,该气体是
⑴尾气是否有可能是单一气体? (填“可能”或“不可能”)。若可能,该气体是
 ⑵原气体中是否有几种(或一种),不可能再存在于尾气之中: (填“有”或“没有”。若有,它们(或它)是
。
⑵原气体中是否有几种(或一种),不可能再存在于尾气之中: (填“有”或“没有”。若有,它们(或它)是
。
 ⑶原气体中是否有几种(或一种)肯定存在于尾气中?
(填“有”或“没有”。若有,它们(或它)是
。
⑶原气体中是否有几种(或一种)肯定存在于尾气中?
(填“有”或“没有”。若有,它们(或它)是
。
30. 2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1
KMnO4溶液处理,发生反应如下:
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1
KMnO4溶液处理,发生反应如下:
 8
8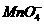 +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
 6
6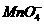 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
 反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。




 (1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:


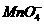 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
 (2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
 (3)欲配制500
mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(3)欲配制500
mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
 (4)混合物中Cu2S的质量分数为_________。
(4)混合物中Cu2S的质量分数为_________。
29. 已知下列变化过程中,0.2 mol RxO
已知下列变化过程中,0.2 mol RxO 参加反应时,共转移0.4 mol电子。
参加反应时,共转移0.4 mol电子。
 RxO
RxO +MnO
+MnO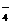 +H+
+H+ RO2+Mn2++H2O
RO2+Mn2++H2O
 (1)x值为__________。
(1)x值为__________。
 (2)参加反应的H+的物质的量为__________mol。
(2)参加反应的H+的物质的量为__________mol。
28. 绿矾在强热条件下分解,生成H2SO4、SO2、Fe2O3和H2O,每生成1 mol H2SO4时,分解绿矾的物质的量是__________________。
绿矾在强热条件下分解,生成H2SO4、SO2、Fe2O3和H2O,每生成1 mol H2SO4时,分解绿矾的物质的量是__________________。
27. 已知Cu2S与某浓度的HNO3反应时,生成Cu(NO3)2和H2SO4,若反应中Cu2S与HNO3的质量比为320:819,则该反应的还原产物为__________________。
已知Cu2S与某浓度的HNO3反应时,生成Cu(NO3)2和H2SO4,若反应中Cu2S与HNO3的质量比为320:819,则该反应的还原产物为__________________。
26. ① 在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
① 在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
 ② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
 ③ 对比①和②实验所得的结果,将I2、ClO-、SO
③ 对比①和②实验所得的结果,将I2、ClO-、SO 按氧化性由强到弱的顺序排列为___________________。
按氧化性由强到弱的顺序排列为___________________。
25. 智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
 (1)反应中_____________元素被氧化,_____________是氧化剂。
(1)反应中_____________元素被氧化,_____________是氧化剂。
 (2)用短线标出电子转移方向和总数。
(2)用短线标出电子转移方向和总数。
 (3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
24. 配平化学方程式
配平化学方程式
 KMnO4+FeS+H2SO4--MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
KMnO4+FeS+H2SO4--MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
26.答案:(A)(1)a、b (2)干燥气体 控制氢气和氮气的流速




(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
 (5)4NH3+5O2 4NO+6H2O
(5)4NH3+5O2 4NO+6H2O
(6)NH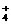 NO
NO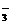
(B)(1)C E B
(2)A B (3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体
(5)4 (6)a
解析:(A)(1)由题给反应物的状态,NaNO2和NH4Cl都是饱和溶液,可推知N2用a装置,而H2是由锌粒(固)和稀酸(液)来制取,则可用b制取。
(2)干燥气体和调节(或控制)H2和N2的流速。
 (3)不会,因合成氨的反应是一个可逆反应,生成的混合气体除NH3以外还有大量的N2和H2存在。
(3)不会,因合成氨的反应是一个可逆反应,生成的混合气体除NH3以外还有大量的N2和H2存在。
(4)从能使铂丝保持红热可以推知,氨的氧化反应是一个放热反应。根据氨氧化的产物看有NO生成,NO被O2氧化又产生NO2,所以锥形瓶中会看到有红棕色气体产生。
 (5)乙装置中氨氧化的反应方程式为4NH3+5O2 4NO+6H2O。
(5)乙装置中氨氧化的反应方程式为4NH3+5O2 4NO+6H2O。
(6)因氨氧化生成的NO与O2、H2O反应生成HNO3,未氧化的氨与HNO3反应生成NH4NO3。因此,反应结束后,锥形瓶内的溶液中除有H+、OH-外,还应有NH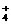 和NO
和NO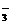 。
。
(B)(1)因坩埚加热后温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,并且为防止坩埚炸裂和烧坏桌面,烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。
(2)灼烧后含有少量铜其原因可能是灼热不充分,铜未被完全氧化,也可能是灼烧过程中部分氧化铜被还原。




(3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其干燥,由此可写出答案。

 (4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀)
2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
(4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀)
2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
(5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚;
④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。
(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。
25.答案:(1)样品重,砝码轻
(2)防止空气中的CO2和水汽进入U型管中
(3)偏高
(4)把反应产生的CO2全部导入U型管中
(5)判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收
 (6)
(6)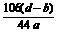 ×100%
×100%
(7)将a g样品溶解后加入硝酸酸化的AgNO3溶液,充分反应后过滤,将沉淀干燥后称量得b g沉淀。由NaCl-AgCl得NaCl的质量为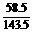 b,则Na2CO3的质量为(a-
b,则Na2CO3的质量为(a-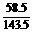 b),所以Na2CO3的质量分数为
b),所以Na2CO3的质量分数为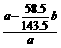 ×100%。
×100%。
解析:本题为定量综合实验题,主要考查常用仪器托盘天平的使用操作、干燥管的作用及实验设计能力与评价能力。
(1)托盘天平称量时,左盘放药品、右盘放砝码,若指针左偏,说明左盘较重,也就是药品质量大于砝码质量。(2)通过称量实验开始和结束时U形管的质量,可以确定产生CO2的质量,在U形管后接一个干燥管,可以防止空气中的CO2、水蒸气等进入U形管,使实验结果更为准确。(3)因盐酸是挥发性酸,生成的CO2中会混有HCl,它不能被浓H2SO4除去,但可以被碱石灰吸收,也就是实验结束后碱石灰的质量会偏大,测量的结果会偏高。(4)CO2的密度较大,生成的CO2可能会残留在锥形瓶中,鼓入空气可让生成的CO2全部导入U形管中。(5)如果两次称量U形管的结果基本不变,说明锥形瓶中所有的CO2都被碱石灰吸收了。
 (6)Na2CO3+H2SO4 Na2SO4+H2O+CO2↑
(6)Na2CO3+H2SO4 Na2SO4+H2O+CO2↑
106 g 44 g
m(Na2CO3) (d-b)g
所以,Na2CO3的质量分数为: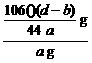 ×100%
×100%
=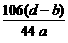 ×100%
×100%
(7)该实验的方法较多,比如可以称量一定质量的样品,加入足量的稀HNO3使CO2全部放出后滴加足量AgNO3,过滤洗净沉淀,称量后通过计算也能确定样品的纯度。其他方法只要原理正确,操作可行都是可以的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com