
题目列表(包括答案和解析)
8.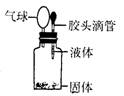 某同学如图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是 ( )
某同学如图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是 ( )
 A.二氧化锰和浓盐酸 B.铁与浓硫酸
A.二氧化锰和浓盐酸 B.铁与浓硫酸
 C.铜与浓硫酸
D.过氧化钠和水
C.铜与浓硫酸
D.过氧化钠和水
7. 下列实验中,溶液颜色有明显变化的是
( )
下列实验中,溶液颜色有明显变化的是
( )
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO4溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
6.在下列所指的各溶液中,分别滴加NH4SCN溶液后,溶液不呈血红色的是 ( )。
A.加入足量镁粉的Fe2(SO4)3溶液
B.加入过量铁粉的稀硝酸溶液
C.铁丝在足量的氯气中燃烧后,所得产物的溶液
D.长期暴露在空气中的绿矾溶液
5.某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是 ( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
4.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是( )。
A.1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3
3.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是 ( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
2.下列离子方程式书写正确的是( )
A.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2==Fe3+ + Br2+ 4Cl-
B.三氯化铁溶液跟过量氨水反应 Fe3++3NH3•H2O == Fe(OH)3↓+3NH4+
C.硫化亚铁与盐酸反应 S2-+2H+==H2S↑
D.过量铁粉与稀HNO3反应:Fe+4H++NO3-= Fe3++NO↑+2H2O
1.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是 ( )
A.只有Fe2+ B.只有Fe3+
C.有Fe2+和Cu2+ D.有Fe3+和Cu2+
33. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
 (1)冶炼铜的反应为8CuFeS2+21O2
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(填元素符号)。
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(填元素符号)。
 (2)上述冶炼过程中产生大量SO2。下列处理方案合理的是
(填代号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是
(填代号)。
 a.高空排放
a.高空排放
 b.用于制备硫酸
b.用于制备硫酸
 c.用纯碱溶液吸收制Na2SO3
c.用纯碱溶液吸收制Na2SO3
 d.用浓硫酸吸收
d.用浓硫酸吸收
 (3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
 S2O82-+2I-=2SO42-+I2
S2O82-+2I-=2SO42-+I2
 通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。
、
(不必配平)。
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。
、
(不必配平)。
 (4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
 ①用稀盐酸浸取炉渣,过滤。
①用稀盐酸浸取炉渣,过滤。
 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
 据以上信息回答下列问题:
据以上信息回答下列问题:
 a.除去Al3+的离子方程式是
。
a.除去Al3+的离子方程式是
。
 b.选用提供的试剂,设计实验验证炉渣中含有FeO。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
 提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
 所选试剂为
。证明炉渣中含有的实验现象为
所选试剂为
。证明炉渣中含有的实验现象为
 。
。






32. 从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
 (1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________原子还原性最强;Cu2+、Fe2+、Ag+中,_______________离子氧化性最强。
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________原子还原性最强;Cu2+、Fe2+、Ag+中,_______________离子氧化性最强。
 (2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com