
题目列表(包括答案和解析)
5. 焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
4.下列对碱金属铷(Rb)的叙述中,正确的是 ( )
A.灼烧氯化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
3.将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
A、 B、
B、 C、
C、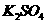 D、
D、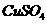
2.下列关于钠的说法不正确的是 ( )
A.金属钠和氧气反应,条件不同,产物不同
B.钠钾合金通常状况下呈液态,可作原子反应堆的导热剂
C.钠的化学活泼性很强,少量的钠可保存在有机溶剂 中
中
D.由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表中钠后面的金属
1.下列关于钠与水反应的说法不正确的是 ( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红;②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应;③钠在水蒸气中反应时因温度高会发生燃烧;④将两小块质量相等的金属钠,一块直接投入水中,另一块用锡箔包住,在锡箔上刺些小孔,然后按入水中,两者放出的氢气质量相等。
A.①② B.②③ C.②③④ D.①②③④
33. 已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
 完成以下实验探究过程:
完成以下实验探究过程:
 (1)提出假设:
(1)提出假设:
 假设1:该混合金属粉末中除铝外还含有 元素;
假设1:该混合金属粉末中除铝外还含有 元素;
 假设2:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
 假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
 (2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
 (3)实验过程
(3)实验过程
 根据(2)的实验方案,叙述实验操作、预期现象和结论。
根据(2)的实验方案,叙述实验操作、预期现象和结论。
 [提示]Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
[提示]Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
32. 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂
 等。
等。





 (1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
。
 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。

 正极反应
负投反应
。
正极反应
负投反应
。
 (3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
Fe3+ Fe2+ Fe2+ Cu2+ Cu2+ |
1.9 7.0 7.0 4.7 4.7 |
3.2 9.0 9.0 6.7 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
 有关反应的化学方程式
有关反应的化学方程式
 劣质不锈钢腐蚀的实验现象
劣质不锈钢腐蚀的实验现象
31. 铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入10mL 6mol·L-1HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入10mL 6mol·L-1HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
 (1)写出Cu2O跟稀硝酸反应的化学反应方程式__________ __ 。(不必配平)
(1)写出Cu2O跟稀硝酸反应的化学反应方程式__________ __ 。(不必配平)
 (2)产物中硝酸铜的物质的量______________mol;
(2)产物中硝酸铜的物质的量______________mol;
 (3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol
 (4)如混合物中Cu的物质的量为x,求x的取值范围________________。
(4)如混合物中Cu的物质的量为x,求x的取值范围________________。
30. 如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:

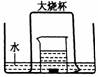 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
 (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是:
 ①_______________________________ ;
①_______________________________ ;
 ②_______________________________ ;
②_______________________________ ;
 ③_______________________________ ;
③_______________________________ ;
 ④_______________________________ 。
④_______________________________ 。
 (3)用该装置做铜与浓硝酸反应实验的优点:______________
;
(3)用该装置做铜与浓硝酸反应实验的优点:______________
;

 (4)大烧杯内最终所得气体产物的化学式:
;若要验证此气体产物,最简便的方法:_________________________________________
。
(4)大烧杯内最终所得气体产物的化学式:
;若要验证此气体产物,最简便的方法:_________________________________________
。
29. 氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.






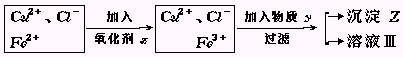
 ↓蒸发结晶
↓蒸发结晶
 CuCl2·2H2O(纯)
CuCl2·2H2O(纯)
 (1)加入氧化剂X的目的是
(1)加入氧化剂X的目的是
 (2)下列氧化剂中最适合本实验的是
(2)下列氧化剂中最适合本实验的是
 A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
 (3)物质Y和沉淀Z的化学式分别是
和
.
(3)物质Y和沉淀Z的化学式分别是
和
.
 (已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com