
题目列表(包括答案和解析)
1.节能减排关系人类的生存环境,请从我做起。下列措施不属于“节能减排”的是
A.及时关灯、关空调、关水龙头,节水、节电
B.使用天然气热水器取代电热水器
C.自2008年6月1日起,实行塑料购物袋有偿使用
D.研制开发燃料电池汽车,减少机动车尾气污染
27. 答案:(1)A,因为中和等量的
答案:(1)A,因为中和等量的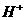 ,
, 比
比 的用量少(质量比为53∶84)。
的用量少(质量比为53∶84)。
 (2)B,因为产生等量的
(2)B,因为产生等量的 时,
时, 比
比 的用量少(质量比为84∶106),且产生
的用量少(质量比为84∶106),且产生 的速率大。
的速率大。
 (3)A,因为
(3)A,因为 碱性强,洗涤效果好。
碱性强,洗涤效果好。
 (4)B,因为适量中和部分胃酸,若用苏打碱性太强,有腐蚀性,不利于人的健康。
(4)B,因为适量中和部分胃酸,若用苏打碱性太强,有腐蚀性,不利于人的健康。
 解析:本题紧扣本节重点,纯碱和小苏打性质联系用途,由课本演示实验可知:
解析:本题紧扣本节重点,纯碱和小苏打性质联系用途,由课本演示实验可知: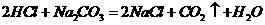 ,
,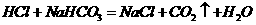 ,等量酸耗苏打的质量相对小;产生等量
,等量酸耗苏打的质量相对小;产生等量 时耗小苏打少;而做洗涤剂和中和胃酸均利用其碱性,前者当然碱性强,洗涤效果好,但碱性太强不利于健康。
时耗小苏打少;而做洗涤剂和中和胃酸均利用其碱性,前者当然碱性强,洗涤效果好,但碱性太强不利于健康。
26. 答案:(1)
答案:(1) 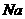 、
、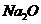 、
、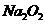 、
、 、
、






 (2)①
(2)①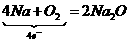 ,
②
,
②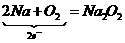 ,
,
 ③
③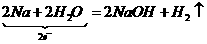 , ④
, ④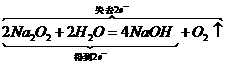 ,
,
 ⑤
⑤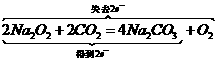 ,
,
 ⑥
⑥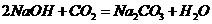 (非氧化还原反应)。
(非氧化还原反应)。
 解析:本题属于根据图示转化关系进行物质判断的测试题,该题以第一步转化“A→B”、“A→C”为突破口,即单质与氧气的反应因条件不同(点燃与常温)而产物不同,根据目前所学,很容易想到金属钠,由此推出B为
解析:本题属于根据图示转化关系进行物质判断的测试题,该题以第一步转化“A→B”、“A→C”为突破口,即单质与氧气的反应因条件不同(点燃与常温)而产物不同,根据目前所学,很容易想到金属钠,由此推出B为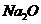 ,C为
,C为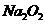 。然后顺其性质往下推,由框图可知A、B、C 3种物质均可转化为D,不难判断D为
。然后顺其性质往下推,由框图可知A、B、C 3种物质均可转化为D,不难判断D为 。最后根据B、C、D在一定条件下都能转化为E,推出E为
。最后根据B、C、D在一定条件下都能转化为E,推出E为 。
。
25. 答案:①水浴加热 ②使反应充分进行 (或使NaHCO3晶体充分析出) ③NaHCO3的溶解度最小 ④NaCl ⑤NH3 + CO2
+ H2O + NaCl
答案:①水浴加热 ②使反应充分进行 (或使NaHCO3晶体充分析出) ③NaHCO3的溶解度最小 ④NaCl ⑤NH3 + CO2
+ H2O + NaCl NH4Cl + NaHCO3↓或NH3 + CO2 + H2O
NH4Cl + NaHCO3↓或NH3 + CO2 + H2O NH4HCO3 ;NH4HCO3 + NaCl
NH4HCO3 ;NH4HCO3 + NaCl NaHCO3↓+ NH4Cl ⑥可取少量试样溶于水,滴加过量稀硝酸,再滴加过量硝酸银,观察最终是否有沉淀 ⑦NH3
NaHCO3↓+ NH4Cl ⑥可取少量试样溶于水,滴加过量稀硝酸,再滴加过量硝酸银,观察最终是否有沉淀 ⑦NH3
 解析:本题以侯德榜制碱法原理和溶解性表为载体考查考生的观察能力、实验设计的评价能力。(1)①由题意知,大于35℃时NH4HCO3分解,若低于30℃反应速率降低,要控制此温度范围应用水浴加热。②保温30分钟时为了使反应充分进行,提高原料的利用率和NaHCO3的产率。③由表可知,只析出NaHCO3晶体的原因是在在30℃-35℃时NaHCO3的溶解度最小。④过滤所得的母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,可以加HCl使之全部生成NaCl。
解析:本题以侯德榜制碱法原理和溶解性表为载体考查考生的观察能力、实验设计的评价能力。(1)①由题意知,大于35℃时NH4HCO3分解,若低于30℃反应速率降低,要控制此温度范围应用水浴加热。②保温30分钟时为了使反应充分进行,提高原料的利用率和NaHCO3的产率。③由表可知,只析出NaHCO3晶体的原因是在在30℃-35℃时NaHCO3的溶解度最小。④过滤所得的母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,可以加HCl使之全部生成NaCl。
24. 答案:(1)防止Na2O2受潮。(2)X是浓硫酸,其作用是除去CO2中的水。Y是CO2的饱和溶液(或水) (3)二氧化碳只有在水存在时才能和过氧化钠反应。
答案:(1)防止Na2O2受潮。(2)X是浓硫酸,其作用是除去CO2中的水。Y是CO2的饱和溶液(或水) (3)二氧化碳只有在水存在时才能和过氧化钠反应。
 (4)除去混在氧气中的过量二氧化碳。 (5)B、E
(4)除去混在氧气中的过量二氧化碳。 (5)B、E
 解析:实验的目的:探究二氧化碳是否在水存在时才能和过氧化钠反应。实验甲是干燥的二氧化碳和过氧化钠的反应,故在实验以前应干燥CO2气体,试剂X是浓硫酸。实验乙是潮湿的二氧化碳和过氧化钠的反应,在试管Ⅰ内装入试剂应使二氧化碳变成潮湿的二氧化碳,试剂Y是CO2的饱和溶液(或水)。为了确保实验现象的准确性,制备CO2所用的反应物最好选用稀硫酸,因盐酸、稀硝酸有挥发性,而大理石与稀硫酸反应生成硫酸钙微溶,故选用小苏打。
解析:实验的目的:探究二氧化碳是否在水存在时才能和过氧化钠反应。实验甲是干燥的二氧化碳和过氧化钠的反应,故在实验以前应干燥CO2气体,试剂X是浓硫酸。实验乙是潮湿的二氧化碳和过氧化钠的反应,在试管Ⅰ内装入试剂应使二氧化碳变成潮湿的二氧化碳,试剂Y是CO2的饱和溶液(或水)。为了确保实验现象的准确性,制备CO2所用的反应物最好选用稀硫酸,因盐酸、稀硝酸有挥发性,而大理石与稀硫酸反应生成硫酸钙微溶,故选用小苏打。
23. 答案:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
答案:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
 (2)B 饱和NaHCO3 除CO2中的HCl
(2)B 饱和NaHCO3 除CO2中的HCl
 C Na2O2粉末
反应物
C Na2O2粉末
反应物
 D NaOH溶液 除去未反应的CO2
D NaOH溶液 除去未反应的CO2
 (3)2Na2O2+2CO2=2Na2CO3+O2 (4)将带火星的木条插入试管检验木条能否复燃。
(3)2Na2O2+2CO2=2Na2CO3+O2 (4)将带火星的木条插入试管检验木条能否复燃。
 解析:要证明过氧化钠可作供氧剂,必须验证实验产物是O2,故实验目的就是验证过氧化钠与水或二氧化碳的反应。实验仪器中的A是二氧化碳发生装置,B、D是除杂装置,C是反应装置,E是尾气处理与收集装置。本实验可能存在的杂质气体有:HCl和水,但由于过氧化钠与二氧化碳的反应是离子反应,故水不必除去。试管F中收集满气体后,下一步实验操作应是验证实验产物是O2。为检验生成的O2应将试管F从水槽中取出,然后用带火星的木条伸入管口进行检验,但是取出F前,应将装置A中的反应停止。
解析:要证明过氧化钠可作供氧剂,必须验证实验产物是O2,故实验目的就是验证过氧化钠与水或二氧化碳的反应。实验仪器中的A是二氧化碳发生装置,B、D是除杂装置,C是反应装置,E是尾气处理与收集装置。本实验可能存在的杂质气体有:HCl和水,但由于过氧化钠与二氧化碳的反应是离子反应,故水不必除去。试管F中收集满气体后,下一步实验操作应是验证实验产物是O2。为检验生成的O2应将试管F从水槽中取出,然后用带火星的木条伸入管口进行检验,但是取出F前,应将装置A中的反应停止。
22. 答案:(1)A:碳(或C) C:钠(或Na);(2)Na2CO3+2HCl
答案:(1)A:碳(或C) C:钠(或Na);(2)Na2CO3+2HCl 2NaCl+H2O+CO2↑
2NaCl+H2O+CO2↑
 (3)2CO2+2Na2O2
(3)2CO2+2Na2O2 2Na2CO3+O2;(4)Na2O2+S2-+2H2O
2Na2CO3+O2;(4)Na2O2+S2-+2H2O 4OH-+S↓+2Na+
4OH-+S↓+2Na+
 解析:F的焰色反应呈黄色,说明F是钠的化合物,而F是单质B、C化合而成,B、E均为组成空气的成分,故C为金属钠;G是单质C、D化合而成,原子个数比为D∶ C=1∶2,且原子序数D>C,故D为硫;B为组成空气的成分,最容易想到的是O2,如B为O2,E也为组成空气的成分,E只能是CO2,A即为碳。F是Na2O2还是Na2O?联系:F+E=H+B,故F是Na2O2,H是Na2CO3。
解析:F的焰色反应呈黄色,说明F是钠的化合物,而F是单质B、C化合而成,B、E均为组成空气的成分,故C为金属钠;G是单质C、D化合而成,原子个数比为D∶ C=1∶2,且原子序数D>C,故D为硫;B为组成空气的成分,最容易想到的是O2,如B为O2,E也为组成空气的成分,E只能是CO2,A即为碳。F是Na2O2还是Na2O?联系:F+E=H+B,故F是Na2O2,H是Na2CO3。
21. 答案:(1)按住橡皮塞,将大头针向上拔出。(2)钠在煤油的表面与水和煤油接触的界面之间上下沉浮,并不断减少直至消失;同时有气泡产生。(3)长;①钾的密度比钠小;②产生少量气体即可使钾上浮进入煤油中(每次反应的量少);③钾的密度与煤油接近,在煤油中滞留时间长。
答案:(1)按住橡皮塞,将大头针向上拔出。(2)钠在煤油的表面与水和煤油接触的界面之间上下沉浮,并不断减少直至消失;同时有气泡产生。(3)长;①钾的密度比钠小;②产生少量气体即可使钾上浮进入煤油中(每次反应的量少);③钾的密度与煤油接近,在煤油中滞留时间长。





 解析:从图可见,钠被大头针固定在煤油中,而钠的密度比煤油大,重力的作用可使钠在失去固定后下落;反应开始后,钠将落在煤油和水[ρ(钠) <ρ(水)]的界面上,有气泡产生,使钠块上浮,当附着在钠块表面的氢气逸出后,钠块又下沉到水和煤油的界面上,又发生反应,重复发生上述现象直至钠块反应耗尽逐渐消失。
解析:从图可见,钠被大头针固定在煤油中,而钠的密度比煤油大,重力的作用可使钠在失去固定后下落;反应开始后,钠将落在煤油和水[ρ(钠) <ρ(水)]的界面上,有气泡产生,使钠块上浮,当附着在钠块表面的氢气逸出后,钠块又下沉到水和煤油的界面上,又发生反应,重复发生上述现象直至钠块反应耗尽逐渐消失。
20. 答案:2Na2O2+2C02==2Na2CO2+O2(2分), 2Na2O2+2H20==4NaOH+O2。
答案:2Na2O2+2C02==2Na2CO2+O2(2分), 2Na2O2+2H20==4NaOH+O2。
 补充适量的水蒸气
消耗等质量的C02,KO2释放出的O2比Na202更多
补充适量的水蒸气
消耗等质量的C02,KO2释放出的O2比Na202更多
 解析:过氧化钠可与飞船座舱内的CO2和水蒸气反应:
解析:过氧化钠可与飞船座舱内的CO2和水蒸气反应:
 2Na2O2+2C02==2Na2CO2+O2, 2Na2O2+2H20==4NaOH+O2。
2Na2O2+2C02==2Na2CO2+O2, 2Na2O2+2H20==4NaOH+O2。
 由于人呼出的CO2的质量远大于水蒸气的质量,故先考虑CO2与Na202反应生成O2,由方程式计算知,宇航员呼出1.0kgC02与Na2O2反应,产生的O2为0.36kg,小于宇航员需要消耗的0.9kg氧气,故需通过补充水蒸气,既用于补充所需的氧气,又能维持空气成分的稳定。KO2与CO2的反应方程式为:4KO2+2CO2==2K2CO3+302,可以计算1.0kgCO2与KO2反应生成O2的质量为1.1kg,可见释放的O2更多
由于人呼出的CO2的质量远大于水蒸气的质量,故先考虑CO2与Na202反应生成O2,由方程式计算知,宇航员呼出1.0kgC02与Na2O2反应,产生的O2为0.36kg,小于宇航员需要消耗的0.9kg氧气,故需通过补充水蒸气,既用于补充所需的氧气,又能维持空气成分的稳定。KO2与CO2的反应方程式为:4KO2+2CO2==2K2CO3+302,可以计算1.0kgCO2与KO2反应生成O2的质量为1.1kg,可见释放的O2更多
19. 答案:A、D
答案:A、D
 解析:与盐酸反应产生气体的物质可能有
解析:与盐酸反应产生气体的物质可能有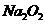 、
、 和
和 ,气体X通过足量的
,气体X通过足量的 溶液后体积缩小(而不是气体全部消失),说明X由
溶液后体积缩小(而不是气体全部消失),说明X由 和
和 组成,原粉末中
组成,原粉末中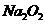 、
、 和
和 至少有一种一定存在。将原混合粉末加热,有气体放出,说明混合物中一定有
至少有一种一定存在。将原混合粉末加热,有气体放出,说明混合物中一定有 ,但
,但 受热分解会使混合物粉末质量减少,而实际剩余固体的质量都增加了,原因只能是发生了反应:
受热分解会使混合物粉末质量减少,而实际剩余固体的质量都增加了,原因只能是发生了反应: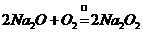 。综上分析,混合物中有
。综上分析,混合物中有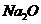 、
、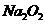 、
、 ,无法确定混合物中是否有
,无法确定混合物中是否有 和
和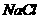 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com