
题目列表(包括答案和解析)
1.下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO- + H3O+
HCOO- + H3O+
B.CO2+H2O HCO3- + H+
HCO3- + H+
C.CO32- + H2O HCO3- + OH-
HCO3- + OH-
D.HS- + H2O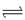 S2- + H3O+
S2- + H3O+
20.(8分)(1)请写出Cr原子基态的电子排布式:______________。
(2)H3O+的空间构型是_____,其中O原子呈____杂化。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,
 据此可判断Fe(CO)5晶体属于 晶体。
据此可判断Fe(CO)5晶体属于 晶体。
(4)某铜的氧化物晶体的晶胞结构如图所示,其中小球表示
Cu原子,在1个晶胞所包含的氧原子数目为 。
19.(15分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
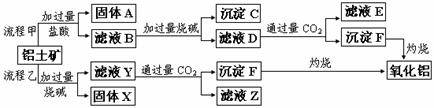
请回答下列问题:
(1)Fe的原子序数为26,Fe位于元素周期表中第_______周期,第______族。
(2)流程甲加入盐酸后生成Al3+的离子方程式为 ;
流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)滤液E中溶质的主要成份是 (填化学式),写出该溶液的一种
用途: 。
(4)写出检验滤液B中是否含Fe3+离子的方法:
18.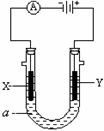 (14分)Ⅰ.右图表示一个电解池,装有电解液a;X、Y是
(14分)Ⅰ.右图表示一个电解池,装有电解液a;X、Y是
两块电极板,通过导线与直流电源相连。若X、Y都是惰性
电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入
几滴酚酞试液,请回答:
(1)X极上的电极反应式: 。
在X极附近观察到的现象是 。
(2)Y电极上的电极反应式为 ,检验该电极反应产物
的方法是 。
Ⅱ.三峡大坝使万里长江变成黄金水道,但三峡船闸的防腐蚀是现实而又紧迫的任务,请你分析:
(1)船闸主要发生的是 腐蚀,并请写出腐蚀的电极反应式:
负极: ;
正极: 。
(2)请你对三峡船闸的防腐蚀提出一项合理化建议:
。
17.(8分)在一定体积的密闭容器中进行如下反应:CO2(g)+H2(g)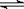 CO(g)+H2O(g);其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g);其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)若向容器中投入各物质2mol,加热到800℃使反应进行,则此时反应的生成物是 。
16.(10分)Ⅰ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是_______________。
(2)该反应中,发生还原反应的过程是 → 。
(3)该反应中氧化剂与还原剂物质的量之比为 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
Ⅱ.已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+ CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
请运用盖斯定律写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方
程式:_________________________________________________________________
15. 在密闭容器中,对于可逆反应A+3B
在密闭容器中,对于可逆反应A+3B  2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
A.A一定为气体
B.B一定为气体
C.该反应是放热反应
D.若正反应方向△H <0,则T1>T 2
第Ⅱ卷 (非选择题 共55分)
14.下列实验操作正确的是
|
编号 |
实验 |
操作 |
|
A |
观察钠与水反应 的现象 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定物质的量浓度的氯化钾溶液 |
准确称取一定质量的氯化钾固体,放入到1000mL的容量瓶中,加水1000mL溶解,振荡摇匀。 |
|
C |
稀释浓硫酸 |
将蒸馏水沿烧杯内壁慢慢注入盛浓硫酸的烧杯中,并用玻璃棒不断搅拌,使产生的热量不断散失 |
|
D |
取出分液漏斗中 的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
13.甲烷燃料电池(电解质是KOH溶液)的总反应为:CH4+2KOH+2O2 = K2CO3 + 3H2O。 下列有关的说法中不正确的是
A.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
B.该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化
C.负极反应式:CH4+3H2O-8e-=CO32-+7H+
D.正极反应式:2O2+4H2O+8e-=8OH-
12.设NA为阿佛加德罗常数,下列叙述中正确的
A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com