
题目列表(包括答案和解析)
23.(12分)为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1 mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?_______________________;理由是____________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:______________________________________。
22.(18分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中
c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb =__________。
=__________。
21.(20分)下图表示几种中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为黑色的非金属固体单质,D可使品红溶液褪色,E在通常状况下是无色无味的液体,G是淡黄色的固体化合物,H是黑色晶体。
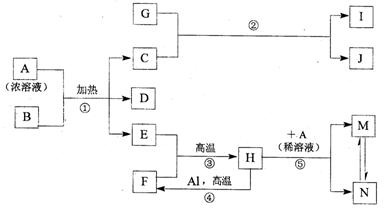
请回答下列问题:
(1)单质F的组成元素在周期表中的位置是 (指明周期和族),G的电子式为 ,化合物Ⅰ的俗名 。
(2)金属Al和H的混合物俗称 ,引发该反应的操作是 。
(3)镁条能在气体C中燃烧得到两种固体,其化学式分别是 、 ;
(4)写出上图中下列反应的化学方程式:
① ;
③ ;
(5)向上图中的反应⑤得到的M、N混合液中通入H2S气体,溶液变浑浊,酸性增强。请写出该过程发生反应的离子方程式: 。
20.某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
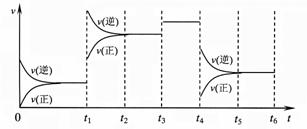
A.t1时升高了温度 B.t3时加入了催化剂
C.t5-t6时刻,Y转化率最小 D.在t3-t4时间内,X的体积分数最大
19.下列溶液中,微粒的浓度关系正确的是
A.0.1mol·L-1 pH为4的NaHSO3溶液中:c(HSO3―) > c(SO32―)> c(H2SO3)
B.等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F―)+c(HF)
C.在NaHA溶液中一定有:c(Na+)+c(H+) = c(HA―)+c(OH―)+c(A2-)
D.c(NH4+)相等浓度的(NH4)2CO3 、(NH4)2SO4和(NH4)2Fe(SO4)2三份溶液物质的量浓度依次增大
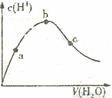
18.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-) =c(NH4+)
B.两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2
C.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性
D.向冰醋酸中逐渐加水,有如图变化:a、b、c三点中水的电离程度最大的是b点
17.将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。则原合金样品中镁的质量为
A.4.8 g B.6 g C.9.6 g D.12 g
16.1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是
A.适当升温,两溶液的pH均增大
B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同
C.0.1
mol/L Na2CO3溶液中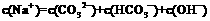
D.0.1
mol/L NH4Cl溶液中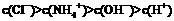
15.工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)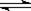 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L-1.min-1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
14.下列离子检验的结论可靠的是
A.用干燥洁净的铂丝蘸取溶液,在火焰上灼烧,若火焰里黄色,证明不含K+
B.向溶液中加入新制氯水和CCl4,振荡、静置,若上层溶液呈紫红色,证明含有I-
C.向溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+
D.向溶液中加入氢氧化钠溶液,若立即产生红褐色沉淀,证明含有Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com