
题目列表(包括答案和解析)
7、下列操作会导致实验结果偏高的是( )
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.定容后反复摇匀发现液面低于刻度,没有再加水,所得溶液的浓度
C.配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数, 所得溶液的浓度
D.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
6.下列有关说法正确的是( )
A.MgCl2、聚氯乙烯、HD均为化合物
B.C2H4O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
5.下列各组变化中,前者是物理变化,后者是化学变化的是( )
A.碘的升华、石油的的分馏
B.用盐酸除金属表面的锈、食盐水导电
C.氢氧化铁胶体加热后凝聚、蓝色的胆矾常温下变白
D.热的饱和KNO3溶液降温析出晶体、二硫化碳洗涤试管内壁上的硫
4. 设nA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是( )
A. 1 mol 硫酸钾中阴离子所带电荷数为nA
B. 乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3nA 个氢原子
C. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA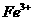
3.下列有关HF、HCI、HBr、HI的说法错误的是( )
A.均为直线型极性分子
B.熔、沸点依次增大
C.稳定性依次减弱
D.还原性依次增强
2. 已知在酸性条件下有以下反应关系:
①KBrO3能将I-氧化成KIO3,本身被还原为Br2;
②Br2能将I-氧化为I2;
 ③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
向KBrO3溶液中滴加少量KI的硫酸溶液后,所得产物除水外还有 ( )
A.Br-、I2 B.Br2、Br-、I2
C.Br2、I2、IO3- D.Br2、IO3-
1.化学与生活、社会密切相关。下列说法不正确的是( )
A.我国规定商家不得无偿提供塑料袋,目的是减少“白色污染”
B.乙醇是一种易燃烧污染小的可再生能源,但只能在实验室内作燃料
C.化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境
D.积极开发废电池的综合利用技术,防止其中的重金属盐对土壤和水源造成污染
33.(15分)请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水。
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:
(2)针对FeCl3水解的影响因素提出假设:
假设 l :溶液的酸碱性 ;
假设 2: ;
假设 3 : 。
(3)基于以上3个假设 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
|
|
|
|
…… |
…… |
…… |
32.(15分)下图是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。(可能用到的相对原子质量: H:1 C:12 N:14 O:16 Cu:64 )
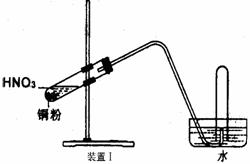

请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为 。
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是 ___________________ 。于是他设计装置Ⅱ,其中装铜片的是气球。
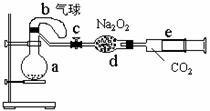 (3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如右:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶。b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球。(整套装置已经过气密性检查合格。)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:
;
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如右:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶。b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球。(整套装置已经过气密性检查合格。)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:
;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳 ml ④将上述全过程用一个总的化学方程式表示:
31.(18分)工业合成氨与制备硝酸一般可连续生产,流程如下:
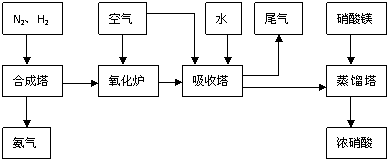

(1)工业生产时,制取氢气的一个反应为:CO+H2O CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)= 。
(2)合成塔中发生反应为:N2(g)+3H2(g)
 2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
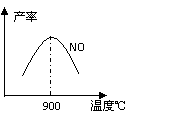 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1
4NO+6H2O △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因 。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com