
题目列表(包括答案和解析)
21.(10分)微生物燃料电池(MFC)是燃料电池中特殊的一类,它利
用微生物作为反应主体,将有机物的化学能转化为电能。以葡萄糖溶
液作底物为例,其工作原理如右图所示。
 已知石墨电极上反应为:
已知石墨电极上反应为:
C6H12O6+6H2O-24e- 6CO2+24H+
⑴ 电池中的质子交换膜只允许质子和水分子通过。电池工作时,质子移向电源的 极,铂碳上所发生的电极反应式为_____________。
⑵ 葡萄糖的燃烧热为2800kJ/mol,写出葡萄糖燃烧的热化学方程式
。
⑶ 化学需氧量(COD)是重要的水质指标,其数值表示将1L水中的有机物氧化为CO2、H2O所需消耗的氧气的质量。科学家设想利用微生物燃料电池来处理某些污水,并进行发电,该设想已经在实验室中获得成功。但如果1L废水中有机物(折算成葡萄糖)氧化提供的化学能低于5.6kJ,就没有发电的必要。则下列污水中,不适合用微生物燃料电池发电的是 (填序号)。
|
序号 |
A |
B |
C |
D |
E |
|
污水类型 |
生活污水 |
印染 |
电镀 |
造纸 |
硫酸工业废水 |
|
COD值(mg/L) |
520 |
870 |
20 |
960 |
120 |
⑷ 在化学工作者的眼中,“垃圾-是放错了位置的资源”。写出硫酸工业“废气”处理利用的化学方程式 。
20.(10分)下图是部分元素的单质及其化合物的转化关系图,反应条件和部分反应中的水已略去。A、E、F是单质,B是红棕色固体,C是家用消毒液的有效成分。G是含+6价元素的含氧酸盐,摩尔质量166g/mol。L是两性物质;反应④、⑤是工业上制取M的重要方法,曾经是我国民族工业的骄傲。

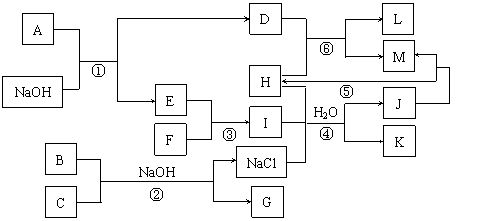
⑴ 写出F的电子式 。
⑵ 写出反应①离子方程式 。
⑶ 写出反应④的化学方程式 。
⑷ G是一种新型净水剂,化学式为 。用G代替氯气和明矾净水的原因是 。
19.(8分)新型无机非金属材料是新材料开发的重要领域,氮化硼(BN)就是其中一种。回答下列问题:
 ⑴ 氮化硼与碳元素的单质相似,有两种重要晶型A型和B型。A型氮
⑴ 氮化硼与碳元素的单质相似,有两种重要晶型A型和B型。A型氮
化硼硬度很高,是特殊的耐磨和切削材料;B型氮化硼化学稳定性较好,
是一种优良的耐高温润滑剂。A型氮化硼结构如右图___________所示
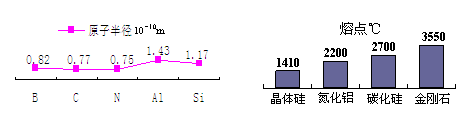 (填“I”或“II”)。
(填“I”或“II”)。
⑵ 结合下列相关数据预测A型氮化硼的熔点范围_________。
⑶ B型氮化硼俗称白石墨。B型氮化硼晶体中六元环与B原子的个数比为 。
⑷ 工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得。写出该反应的化学方程式 。
18.(12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,进行探究。请你协助该小组的同学完成下列研究。
[提出问题]
① Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,A的化学式为 。
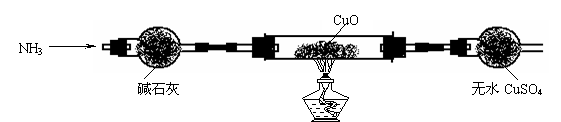 ⑶ 为解决问题③,设计的实验装置为(夹持及尾气处理装置装置未画出):
⑶ 为解决问题③,设计的实验装置为(夹持及尾气处理装置装置未画出):
实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。
[实验结论]
⑴ Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
⑵ 根据“实验方案⑵”,得出的+1价Cu和+2价Cu稳定性大小的结论是 ; 。
⑶ CuO能被NH3还原。该反应的化学方程式为 。
[问题讨论]
⑴ 有同学认为NH3与CuO反应中生成的红色物质是Cu,也有同学认为NH3与CuO反应中生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A ;
17.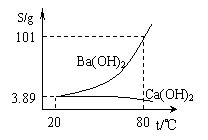 (10分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分
(10分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分
离并提纯碳酸钡的实验步骤如下,请根据要求填空(右图为
Ba(OH)2和Ca(OH)2的溶解度曲线):
⑴ 高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。所需仪
器除坩埚、泥三角、玻璃棒、三脚架外还有 ;
⑵ 将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的
热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作
是 ;
⑶ 将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
⑷ 向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观察
到 时,即可停止通二氧化碳。
⑸ 滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
16.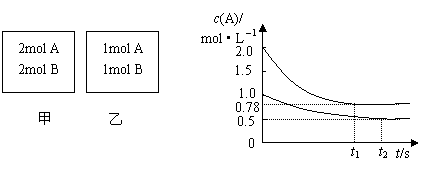 向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g)
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
下列说法正确的是
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
15.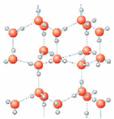 右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。
右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。
下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
14.常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
13.下列有关实验的叙述正确的是
A.浓硝酸可保存在带橡皮塞的棕色细口瓶中
B.用pH试纸测定溶液pH时,pH试纸不应事先润湿
C.配置一定物质的浓度的溶液时,选用的容量瓶规格由需配置的溶液体积决定
D.中和滴定时为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂
12.已知(CH3)2C=CH2可表示为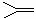 ,脱落酸属植物生长抑制剂,对该物质叙述正确的是
,脱落酸属植物生长抑制剂,对该物质叙述正确的是
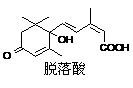 A.分子式为C15H20O4
A.分子式为C15H20O4
B.属于芳香族化合物
C.1mol该物质最多可与3mol H2发生反应
D.在一定条件下发生反应生成含七元环的物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com