
题目列表(包括答案和解析)
19、(6分)A、B、C、D、E、F六种物质的转化关系如下图所示(条件及部分产物未标出)。
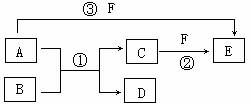
(1)若A、D、F都是非金属单质,常温下,A、D为固体,D单质可作为半导体材料,F为气体,且A、D所含元素为同主族短周期元素,A、F所含元素同周期,则反应①的化学方程式是 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,C的溶液为浅绿色,则反应②(在水溶液中进行)的离子方程式是: 。
(3)若B、C、F都是气态单质,B有毒且呈黄绿色,反应③中有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则反应③的化学方程式是 。
18、(8分)由灰锌(主要在分是ZnO、FeO、Al2O3)制备硫酸锌晶体(ZnSO4·7H2O)是炼锌工厂中废物利用提高效益的重要措施。已知使Zn2+、Fe2+、Fe3+、Al3+沉淀的PH如下表:
|
离子 |
Zn2+ |
Fe2+ |
Fe3+ |
Al3+ |
|
沉淀的PH |
6.5~6.7 |
6.5~6.9 |
2.7~3.7 |
4.9~5.2 |
硫酸锌的制备步骤如下:
(1)称取一定质量的锌灰放入烧杯中,注入15mL蒸馏水,使锌灰润湿,注入6mol·L-1的H2SO450mL,用小火煮沸约一小时。
(2)煮沸过程中,不断搅拌,并加入少量水以补充失去的水分,然后过滤,滤液备用。
(3)向滤液中加入少量的H2O2,煮1~2min,然后调节溶液的PH在5.0~6.0之间。
(4)过滤,并用少量水洗涤沉淀。
(5)向滤液中加入几滴6mol·L-1的硫酸,并小火加热滤液,至液面有晶体析出,停止加热,冷却,过滤,晾干即可。
请回答下列问题:
(1)步骤(3)中加入少量的H2O2目的是 。检验发生这一变化的试剂是 。
(2)步骤(4)中洗涤沉淀的操作是 。
(3)步骤(5)中制备晶体时为什么不将溶液加热蒸干以获得更多的晶体 。
17、(2分)化学实验设计和实验操作中必须十分重视安全问题和环境保护问题,下列实验的设计或操作不合理的是
①实验室用KClO3热分解法制O2,排水收集O2后先停止加热,再拆除实验装置
②实验结束后应将固体残渣深埋入土壤中,废液倒入下水道排出
③给试管中的液体加热时应不时移动试管或加入碎瓷片,以免暴沸伤人
④为检验CO气体的纯度,用排空气法收集一试管气体,然后移近火焰点燃听有无尖锐爆鸣声
16、已知:NaA水溶液呈碱性,常温下将0.10molNaA和0.05molHCl溶于水,得到PH<7的溶液,则溶液中离子浓度由大到小的顺序正确的是
a+)>c(A-)>c(H+)>c(OH-) B. c(A-)>c(Na+)>c(H+)>c(OH-)
C. c(H+)>c(Na+)>c(A-)>c(OH-) D. c(H+)>c(A-)>c(Na+)>c(OH-)
第II卷(非选择题,共52分)
15、镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高而平稳。因而越来越成为人们研制绿色原电池所关注的重点。有一种镁原电池的反应为:

在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移
B.正极反应为:Mo3S4+2xe-=Mo3S42x-
C. Mo3S4发生氧化反应
D.负极反应为:xMg - 2xe- = xMg2+
14、下列关系图中,是一种正盐,是气态氢化物,是单质,是强酸,当无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当是强碱时,过量跟氯气反应除生成外,另一产物是盐酸盐。
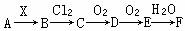
下列说法不正确的是
A.当X是强酸时,ABCDEF均含同一种元素,F可能是硫酸
B.当X是强碱时,ABCDEF均含同一种元素,F是硝酸
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
13、已知在298K时的热化学反应方程式:
C(s,石墨)+O2(g)=CO2(g);△H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g);△H2=-566.0kJ/mol。
则298K时,反应C(s,石墨)+1/2O2(g)=CO (g)的焓变是
A.-110.5 kJ/mol B.-172.5 kJ/mol
C.-676.5 kJ/mol D. -959.5 kJ/mol
12、用惰性电极电解烧杯中盛装的100mL含0.2molCuCl2、0.4molMgCl2的溶液,一段时间后在阳极上产生标准状况下气体11.2L,则在阴极上增重
A.32g B.20g C.12.8g D.12g
11、下列说法中不正确的是
A.现将0.2molCH3COONa晶体和标况下2.24LHCl气体同时溶解于同一烧杯的水中,制得1L溶液,则c(CH3COO-)+ c(CH3COOH)=0.20 mol·L-1
B.25℃时,PH=2的盐酸与PH=2的Ba(OH)2溶液等体积混合后的溶液中一定有:c(H+)=c(OH-)
C. 25℃PH=a的NaOH溶液和PH=b的NaOH溶液等体积混合后PH为14+lg (10-a+10-b)/2
D.常温时,将V1mL c1 mol·L-1的醋酸滴加到V2mL c2 mol·L-1的NaOH溶液中,若混合溶液的PH=7,则c1 V1 >c2 V2
10、一定温度下,在体积为VL的密闭容器中加入1molX和1molY进行如下反应:
X(g)+Y(g)  2Z(g)+W(s);△H>0达到平衡,下列判断正确的是
2Z(g)+W(s);△H>0达到平衡,下列判断正确的是
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2
C平衡后加入X,上述反应的△H增大
D.当容器中混合气体的压强不变时,可以证明反应已达到平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com