
题目列表(包括答案和解析)
6.有一种新型的锂电池,其制作是利用了金属锂和石墨作电极,其电解质溶液是四氯合铝酸锂(LiAlCl4)溶解在二氯亚硫酰(其结构式是: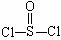 )中形成的,原电池的电极总反应式是:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是
)中形成的,原电池的电极总反应式是:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是
A.电池工作过程中,SOCl2被还原为Li2SO3
B.锂作为电池的负极,石墨作电池的正极
C.该电池内环境应该是无水环境,否则影响电池的寿命
D.电池工作时,锂提供的电子的物质的量与析出硫的物质的量之比是4:1。
5.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:(1)将镁粉投入冷水中,未见任何现象;(2)将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;(3)将镁粉放入液溴中,未观察到任何明显现象;(4)向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只能直接与溴水中的溴反应
B.水是镁粉与溴发生反应的催化剂
C.(2)中产生的极少量气泡是由于镁粉与水反应得到
D.镁粉与溴水中的H+发生反应,导致平衡移动使溴水褪色
4.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列说法正确的是
A.离子半径大小:r(M3+)>r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质可在氧气燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
3.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是
A.2Na218O2+2H2O=4Nal8OH+O2↑
B.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O
C.NH4Cl+2H2O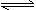 NH3·2H2O+HCl
NH3·2H2O+HCl
D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
2.下列实验或叙述不符合绿色化学理念的是
A.制CuSO4时先将Cu氧化成CuO后再与稀H2SO4反应
B.采用银作催化剂,乙烯和氧气制取环氧乙烷,原子利用率100%
C.用乙醇代替汽油作汽车燃料
D.用稀HNO3 和铜制取Cu(NO3)2
1.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关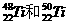 的说法中正确的是
的说法中正确的是
A.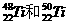 原子中均含有22个中子
原子中均含有22个中子
B.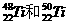 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.分别由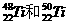 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
D.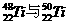 为同一核素
为同一核素
25.(10分)某化工厂以甲烷为原料合成甲醇的反应为:
CH4(g)+H2O(g)→CO(g)+3H2(g) ……………①(反应中CH4转化率:1)
CO(g)+2H2(g)→CH3OH(g) ……………②(反应中CO转化率: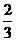 )
)
合成工艺如下(虚线框内为改进后的工艺中新增流程):
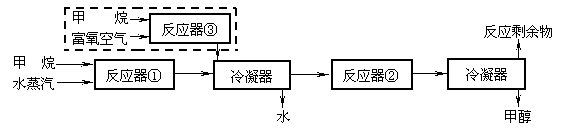
请回答下列问题(所有气体体积均折算为标准状况):
⑴ 原工艺中,当充入反应器①的甲烷和水蒸汽的体积分别为672m3和1750m3时,反应剩余物中
n(CO)= ,n(H2)= 。
⑵ 为充分利用反应剩余物,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:
2CH4(g)+O2(g)→2CO(g)+4H2(g) ………………③(反应中CH4转化率:1)
若新工艺中充入反应器①的甲烷和水蒸汽的体积分别为a、3a,反应剩余物中:
V(H2)∶V(N2)∶V(CO)=3∶1∶1。
计算:
① 充入反应器③的甲烷的体积;
② 若富氧空气中除O2、N2外,其他成分忽略不计,则充入反应器③中的富氧空气的体积为 ;应选择氧气体积分数为 的富氧空气。
24.(8分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
⑴ 正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
⑵ “速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%。该药品中的Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10%即不能再服用。为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000 mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL。通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外的其他成分不与KMnO4反应)
23. (10分)某质子交换膜可通过如下方法合成,部分反应条件未列出。
(10分)某质子交换膜可通过如下方法合成,部分反应条件未列出。
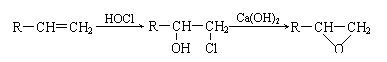
已知:
回答下列问题:
⑴ 反应①-⑧中属于加成反应的是________,反应③的目的是________________________。
⑵ 写出反应⑥的化学方程式__________________________________________________。
⑶ 该质子交换膜在一定条件下可水解生成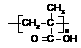 、
、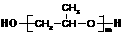 和
和 ,它们的物质的量之比为_____。
,它们的物质的量之比为_____。
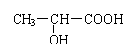 ⑷ 请设计从F制取(用反应流程图表示并注明反应条件)
⑷ 请设计从F制取(用反应流程图表示并注明反应条件)
例:由乙醇合成聚乙烯的反应流程图可表示为:
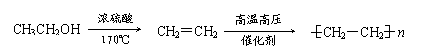
22.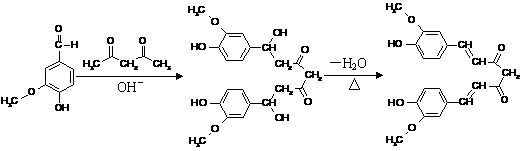 (8分)姜黄素是一种天然染料,工业上可用香草醛与乙酰丙酮通过如下反应得到。
(8分)姜黄素是一种天然染料,工业上可用香草醛与乙酰丙酮通过如下反应得到。
香草醛 中间产物 姜黄素
⑴ 姜黄素中的含氧官能团除甲氧基(CH3O-)外还有________________。
⑵ 写出香草醛符合下列条件的所有同分异构体的结构简式: 。
① 属于芳香酯类;② 苯环上的一氯代物有两种;③ 能与FeCl3溶液发生显色反应。
⑶ 借鉴制取姜黄素的方法也能合成肉桂醛(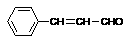 )。写出制备肉桂醛所需有机物的结构简式 、
。
)。写出制备肉桂醛所需有机物的结构简式 、
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com