
题目列表(包括答案和解析)
3.一定量的稀硫酸跟过量铁粉反应,为了减缓反应速率,又不影响生产氢气的总量,可向稀硫酸中加入适量的 ( )
A. (固体) B.
(固体) B.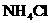 (固体)
(固体)
C.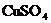 (溶液) D.
(溶液) D.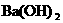 (固体)
(固体)
2.用0.01 mol·L-1的NaOH溶液完全中和下列同物质的量浓度溶液各100 mL,需NaOH溶液体积最大的是 ( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
1.下列对化学反应的认识错误的是 ( )
A.会引起化学键的变化 B.必然引起物质状态的变化
C.会产生新的物质 D.会伴随着能量的变化
2.请将第Ⅰ卷的正确选项用2B铅笔涂在答题卡上,考试结束只收答题卡和第Ⅱ卷。
可能用到的相对原子质量 H:1 C:12 N:14 O:16
第Ⅰ卷 (选择题, 共45分)
选择题(本题15包括小题,每小题3分,共45分。每小题只有一个选项符合题意。)
1.本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时
间90分钟。
23.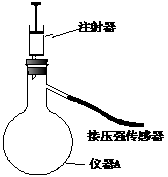 (8分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。实验室常用过氧化氢分解来制取氧气,但过氧化氢在通常情况下分解缓慢,因此实际操作中需要使用催化剂。
(8分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。实验室常用过氧化氢分解来制取氧气,但过氧化氢在通常情况下分解缓慢,因此实际操作中需要使用催化剂。
(1)右图是甲同学就二氧化锰和氧化铁分别对过氧化氢分解催化能力的比较而设计的实验装置。(注:仪器A中的压强可通过压强传感器再与压强采集器相连,可连续测出不同时间点仪器A中的压强值)其主要实验步骤如下:
第一步:按图示将装置连接好;
第二步: ;
第三步:在仪器A中加入少量MnO2,在注射器中加入约5.0mL5%的H2O2溶液;
第四步:接通采集器电源,设置每隔1s测量一次仪器A中的压强,测定点数为70点;
第五步:向仪器A中注入2.0mL H2O2溶液并保持注射器活塞不移动,同时开始测定仪器A中的压强。 再选择氧化铁代替二氧化锰重复上述操作。回答下列问题:
①保存过氧化氢试剂瓶上最适合贴上的一个标签是 (填序号);
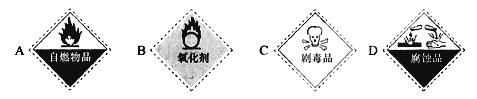
②仪器A的名称是 ;
③上述第二步实验步骤是 ;
④下图Ⅰ是氧化铁和二氧化锰分别催化分解过氧化氢时体系压强的变化曲线(a线表示二氧化锰,b线表示氧化铁),则A点数据的含义是 ,
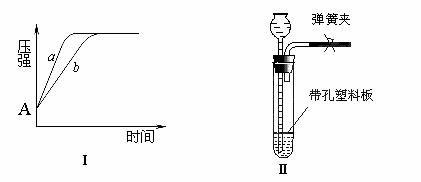
二氧化锰对过氧化氢分解的催化能力比氧化铁 ,判断依据是 。
(2)下图Ⅱ是实验室制取氢气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。乙同学经过认真研究,将二氧化锰粉末与水泥按一定比例制成块状固体后终于创造性地解决了上述问题。你认为他这样做的优点有① ,
②


|

|
 版权所有:()
版权所有:()
版权所有:()
版权所有:()

22、(6分)
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_______________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
21、(13分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为
。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② .
20、(12分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_____________________,
肯定不存在的离子是_____________________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O ②
③ ④HCO3-+H+=H2O+CO2↑
⑤
19.(7分)I、下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1-2 mL饱和的FeC13溶液,并继
续加热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用
滴管吸去多余的部分。
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使
用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好
反应、进行两到三次实验,取平均值
Ⅱ、实验室常用的几种气体发生装置如图A、B、C所示:
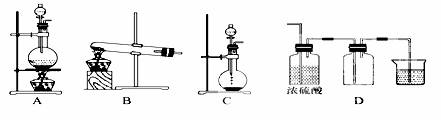
①实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。
②气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是
(填字母,下同);
A.密度 B.颜色 C.溶解性 D.热稳定性 E.与氧气反应
③若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的 。
A.CO2 B.NO C.Cl2 D.H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com