
题目列表(包括答案和解析)
38. 答案:(1)降低Al2O3的熔化温度 (2)下层(3)碳素(或石墨) 阳极(4)c
答案:(1)降低Al2O3的熔化温度 (2)下层(3)碳素(或石墨) 阳极(4)c

 解析:Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温
解析:Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温

 (2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层。
(2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层。

 (3)电解时阳极的碳棒被生成的氧气氧化。
(3)电解时阳极的碳棒被生成的氧气氧化。

 (4)电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好。
(4)电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好。
37. 答案:(1)Al2O3+6H+
答案:(1)Al2O3+6H+ 2Al3++3H2O
2Al3++3H2O





 (2)SiO2+2OH-
(2)SiO2+2OH- SiO32 -+H2O
SiO32 -+H2O
 (3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案:)
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案:)
 (4)NaHCO3;制纯碱或做发酵粉等合理答案:
(4)NaHCO3;制纯碱或做发酵粉等合理答案:
 (5)5.6×10-10mol/L
(5)5.6×10-10mol/L
 解析:本题考查铝土矿中氧化铝提取的工艺流程。(1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5)Ksp= c(Mg2+)·c2(OH-),c(Mg2+)=5.6×10-12/(0.1)2=5.6×10-10。
解析:本题考查铝土矿中氧化铝提取的工艺流程。(1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5)Ksp= c(Mg2+)·c2(OH-),c(Mg2+)=5.6×10-12/(0.1)2=5.6×10-10。
36. 答案:
答案:


 解析:
解析: 本题以周期表为题材,考查原子半径比较,酸性强弱,电子式,离子方程式以及盐类水解等知识。
本题以周期表为题材,考查原子半径比较,酸性强弱,电子式,离子方程式以及盐类水解等知识。
 (1)⑤⑥位于同一周期,且⑤排在⑥的前面,原子半径大,而④在上一周期,比⑤、⑥少一个电子层,故半径最小。
(1)⑤⑥位于同一周期,且⑤排在⑥的前面,原子半径大,而④在上一周期,比⑤、⑥少一个电子层,故半径最小。
 (2)②⑦位于同一主族,上面的非金属性强,最高价含氧酸酸性强,②③位于同一周期,且③在后,非金属性强,对应的酸性强。
(2)②⑦位于同一主族,上面的非金属性强,最高价含氧酸酸性强,②③位于同一周期,且③在后,非金属性强,对应的酸性强。
 (3)四种元素分别为氢、氧、钠和氯,离子键显然必须是钠盐,极性共价键则应有两种非金属组成。
(3)四种元素分别为氢、氧、钠和氯,离子键显然必须是钠盐,极性共价键则应有两种非金属组成。
 (4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。
(4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。
 (5)⑥为Al,可推断Z为Al(OH)3,受热分解可产物Al2O3,再电解即可得单质铝。M仅含非金属的盐,显然铵盐,所以X与Y应为AlCl3与NH3·H2O的反应,生成NH4Cl。由于NH4+ 水解,故要使其浓度与Cl-相等,则要补充NH3·H2O。由电荷守恒知:C(NH4+ )+ C(H+)
(5)⑥为Al,可推断Z为Al(OH)3,受热分解可产物Al2O3,再电解即可得单质铝。M仅含非金属的盐,显然铵盐,所以X与Y应为AlCl3与NH3·H2O的反应,生成NH4Cl。由于NH4+ 水解,故要使其浓度与Cl-相等,则要补充NH3·H2O。由电荷守恒知:C(NH4+ )+ C(H+) C(Cl-)+C(OH-),若C(NH4+ )
C(Cl-)+C(OH-),若C(NH4+ )  C(Cl-),则C(H+)= C(OH-),即pH=7。
C(Cl-),则C(H+)= C(OH-),即pH=7。
35.
 答案:(1)2Al2O3(熔融) 4Al+3O2↑
答案:(1)2Al2O3(熔融) 4Al+3O2↑






 (2)2Al+2OH-+2H2O 2AlO
(2)2Al+2OH-+2H2O 2AlO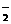 +3H2↑
+3H2↑

 (3)①4OH--4e- 2H2O+O2↑
(3)①4OH--4e- 2H2O+O2↑
 ②H+放电,促进水的电离,OH-浓度增大
②H+放电,促进水的电离,OH-浓度增大
 ③B
③B

 解析:(1)、(2)问主要考查教材的基础知识,应该属于得分的问题,(3)中根据电解原理,阳极应是OH-失电子,所以电极式为4OH--4e- 2H2O+O2↑,而阴极为H+放电,促进水的电离,使OH-浓度增大,所以pH增大,根据阳离子交换膜的特点,K+可从阳极区进入阴极区和OH-组成KOH,从而可在阴极区得纯的KOH,故液体应从B口导出。
解析:(1)、(2)问主要考查教材的基础知识,应该属于得分的问题,(3)中根据电解原理,阳极应是OH-失电子,所以电极式为4OH--4e- 2H2O+O2↑,而阴极为H+放电,促进水的电离,使OH-浓度增大,所以pH增大,根据阳离子交换膜的特点,K+可从阳极区进入阴极区和OH-组成KOH,从而可在阴极区得纯的KOH,故液体应从B口导出。
34. 答案:(1)Al
·· ·· (2)Al3++3-2+6H2O====
4Al(OH)3↓
答案:(1)Al
·· ·· (2)Al3++3-2+6H2O====
4Al(OH)3↓
 (3)光照 过量Cl2 (4)Al4C3+12H2O=== 4Al(OH)3+3CH4↑
(3)光照 过量Cl2 (4)Al4C3+12H2O=== 4Al(OH)3+3CH4↑
 解析:本题为框图推断题,主要考查铝及其化合物的性质与重要应用。由H、G是正四面体
解析:本题为框图推断题,主要考查铝及其化合物的性质与重要应用。由H、G是正四面体
 结构的非极性分子,且H+Cl2→A+G知H为CH4,G为CCl4,A为HCl;联想乙炔的制法及K
结构的非极性分子,且H+Cl2→A+G知H为CH4,G为CCl4,A为HCl;联想乙炔的制法及K
 由两种常见元素组成,可推测I为金属氢氧化物,又I高温J(高温材料),则其中金属可能为
由两种常见元素组成,可推测I为金属氢氧化物,又I高温J(高温材料),则其中金属可能为
 Mg或Al。又HCl+B→D+E,B+C→F+E,D+F→I(金属氢氧化物),可知E为H2,I为Al(OH)3,
Mg或Al。又HCl+B→D+E,B+C→F+E,D+F→I(金属氢氧化物),可知E为H2,I为Al(OH)3,
 B为Al,C为NaOH,全部物质至此全部确定。
B为Al,C为NaOH,全部物质至此全部确定。
33. 答案:(1)Al
C Na2O2 (2)2H2O +Na2O2 =4NaOH+O2↑ 2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
答案:(1)Al
C Na2O2 (2)2H2O +Na2O2 =4NaOH+O2↑ 2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑

 (3)CO2 CO (4)Na2CO3 (5)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
(3)CO2 CO (4)Na2CO3 (5)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
 解析:D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3
,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
解析:D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3
,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
32. 答案:(10分)(1)B 目的是除去空气中的水蒸气,避免反应④发生;D 目的是除去空气中的CO2,避免反应③发生;F 目的是除去空气中的O2,避免反应①发生。
答案:(10分)(1)B 目的是除去空气中的水蒸气,避免反应④发生;D 目的是除去空气中的CO2,避免反应③发生;F 目的是除去空气中的O2,避免反应①发生。
 (2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
 (3)制得的氮化镁将不纯
因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应
(3)制得的氮化镁将不纯
因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应





 (4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁
 解析:本实验的目的是:在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2),而实
解析:本实验的目的是:在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2),而实
 验中,氧气、二氧化碳和水都能与镁反应,所以在把氮气通入A之前要除去空气中的氧气、
验中,氧气、二氧化碳和水都能与镁反应,所以在把氮气通入A之前要除去空气中的氧气、
 二氧化碳和水蒸气,除去氧气要用装置F,除去二氧化碳要用装置D,除去水蒸气要用装置
二氧化碳和水蒸气,除去氧气要用装置F,除去二氧化碳要用装置D,除去水蒸气要用装置
 B,并且除去的由前到后的顺序为:二氧化碳-水蒸气(从装置D中会带出水蒸气)-氧气。
B,并且除去的由前到后的顺序为:二氧化碳-水蒸气(从装置D中会带出水蒸气)-氧气。
31. 答案:(1)78;100。
答案:(1)78;100。





 (2)取滤液少许,加入NaOH,加热,生成的气体能使湿润的红色石蕊试纸变蓝。
(2)取滤液少许,加入NaOH,加热,生成的气体能使湿润的红色石蕊试纸变蓝。
 (3)Al(OH)3;Al2O3;Fe2O3.
(3)Al(OH)3;Al2O3;Fe2O3.
 (4)K2SO4;(NH4)2SO4。
(4)K2SO4;(NH4)2SO4。
 (5)BaCl2;过滤;洗涤;干燥。
(5)BaCl2;过滤;洗涤;干燥。
 (6)mol。
(6)mol。
 解析:(1)根据稀释前后溶质的质量不变得:0.5L×39.2g/L=v×251.28g/L,v=0.078L=
解析:(1)根据稀释前后溶质的质量不变得:0.5L×39.2g/L=v×251.28g/L,v=0.078L=
 78mL。为了减少误差,最好选用与氨水的实际体积稍大一点的量筒即可。(2)NH4+的检
78mL。为了减少误差,最好选用与氨水的实际体积稍大一点的量筒即可。(2)NH4+的检
 验方法是:先将NH4+中加入强碱,使之转化为NH3,然后检验NH3即可。(3)Al3++
验方法是:先将NH4+中加入强碱,使之转化为NH3,然后检验NH3即可。(3)Al3++
 3NH3·H2O===Al(OH)3↓+3NH4+,根据题意明矾石中含有Al2O3、Fe2O3,所以沉淀物为
3NH3·H2O===Al(OH)3↓+3NH4+,根据题意明矾石中含有Al2O3、Fe2O3,所以沉淀物为
 Al(OH)3、Al2O3和Fe2O3。(4)由于明矾石的组成与明矾相似,所以滤液的成分中含有K2SO4
Al(OH)3、Al2O3和Fe2O3。(4)由于明矾石的组成与明矾相似,所以滤液的成分中含有K2SO4
 和反应后生成的(NH4)2SO4以及水。(5)混合肥料中含有K2SO4和(NH4)2SO4,要产生白色
和反应后生成的(NH4)2SO4以及水。(5)混合肥料中含有K2SO4和(NH4)2SO4,要产生白色
 沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液,以后的操作为:先将混合液过滤,然后洗涤,
沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液,以后的操作为:先将混合液过滤,然后洗涤,
 最后干燥,冷却后称量。(6)根据题意有:174n(K2SO4)+132N[(NH4)2SO4]=mg……①,再
最后干燥,冷却后称量。(6)根据题意有:174n(K2SO4)+132N[(NH4)2SO4]=mg……①,再
 由SO42-守恒得:n(K2SO4)+n[(NH4)2SO4]=nmol……②,n(K2SO4)=mol。
由SO42-守恒得:n(K2SO4)+n[(NH4)2SO4]=nmol……②,n(K2SO4)=mol。
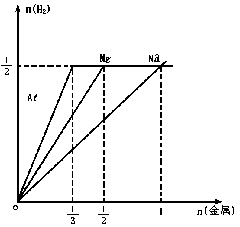
30. 答案:①n<1/2 ② 1/2≤n<1
答案:①n<1/2 ② 1/2≤n<1
 ③n=1
④n>1
③n=1
④n>1
 解析:化学反应中,反应物与生成物的量通常成线性关系,作图时可利用特殊点(如刚开始反应,恰好完全反应等)画出投入金属量与产生氢气量的关系图,各种情况一目了然.
解析:化学反应中,反应物与生成物的量通常成线性关系,作图时可利用特殊点(如刚开始反应,恰好完全反应等)画出投入金属量与产生氢气量的关系图,各种情况一目了然.

 根据Na-H+- H2
Mg-2H+-H2
根据Na-H+- H2
Mg-2H+-H2
 Al-3H+- H2
Al-3H+- H2
 对于Na:起点O(0,0),盐酸恰好完全反应时为A点(1,1/2 );
对于Na:起点O(0,0),盐酸恰好完全反应时为A点(1,1/2 );
 对于Mg:起点O(0,0),盐酸恰好完全反应时为B点( 1/2、1/2 );
对于Mg:起点O(0,0),盐酸恰好完全反应时为B点( 1/2、1/2 );
 对于Al:起点O(0,0),盐酸恰好完全反应时为C点(1/3 ,1/2 )
对于Al:起点O(0,0),盐酸恰好完全反应时为C点(1/3 ,1/2 )
 显然,当n<1/2 时,Na<Mg<Al
显然,当n<1/2 时,Na<Mg<Al
 当 1/2≤n<1时,Na<Mg=Al
当 1/2≤n<1时,Na<Mg=Al
 当n=1时,Na=Mg=Al
当n=1时,Na=Mg=Al
 当n>1时,Na>Mg=Al.
当n>1时,Na>Mg=Al.
29. 答案:1.A 2.B 3.K 4.C、D 5.H 6.E 7.F 8.G 9.I
答案:1.A 2.B 3.K 4.C、D 5.H 6.E 7.F 8.G 9.I
 解析:要根据每个反应的反应物间物质的量的关系,来判断符合哪个图象,熟悉相关化学方程式的书写。
解析:要根据每个反应的反应物间物质的量的关系,来判断符合哪个图象,熟悉相关化学方程式的书写。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com