
题目列表(包括答案和解析)
6. 下列实验能证明某无色气体为SO2的是
( )
下列实验能证明某无色气体为SO2的是
( )
 ①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红
③能使品红试液褪色,加热后又显红色 ④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红
③能使品红试液褪色,加热后又显红色 ④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
 A.①②③④ B.①③④
C.③④ D.②③④
A.①②③④ B.①③④
C.③④ D.②③④
5. 下列有关硫的说法正确的是
( )
下列有关硫的说法正确的是
( )
 A.硫在自然界中仅以化合态存在 B.硫可溶于水
A.硫在自然界中仅以化合态存在 B.硫可溶于水
 C.硫单质在与Cu、Fe、O2的反应中均作氧化剂
D.硫易溶于二硫化碳
C.硫单质在与Cu、Fe、O2的反应中均作氧化剂
D.硫易溶于二硫化碳
4. 下列关于硫的叙述中,正确的是 ( )
下列关于硫的叙述中,正确的是 ( )

 A. 硫的非金属性较强,故只能以化合态存在于自然界中
A. 硫的非金属性较强,故只能以化合态存在于自然界中
 B. 能与Cu、Fe、O2等物质反应,S作氧化剂
B. 能与Cu、Fe、O2等物质反应,S作氧化剂
 C. 硫燃烧得SO3 ,可以制得硫酸
C. 硫燃烧得SO3 ,可以制得硫酸
 D. S与Cu反应生成Cu2S ,而不能生成CuS
D. S与Cu反应生成Cu2S ,而不能生成CuS
3.下列反应适用于实验室制备氧气的是 ( )
①高锰酸钾热分解
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
②硝酸铵热分解
2NH4NO3 4H2O+2N2↑+O2↑
4H2O+2N2↑+O2↑
③过氧化氢催化分解2H2O2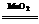 2H2O+O2↑
2H2O+O2↑
④二氧化氮热分解2NO2 2NO+O2
2NO+O2
A.只有① B.①和② C.①和③ D.①③④
2.过氧化氢的沸点比水高,但受热容易分解。某试剂厂制得7%-8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是( )
A.常压蒸馏 B.减压蒸馏 C.加生石灰常压蒸馏 D.加压蒸馏
1.判断氧的非金属性比硫强的事实是( )
A.氢硫酸敞口放置于空气中变浑浊
B.常温下Hg不与O2反应而与硫粉反应
C. Fe在氧气中燃烧生成Fe3O4,而与硫反应生成FeS
D.氧的游离态大量存在于空气中;而硫的游离态主要存在于火山口喷口处
42. 答案:(1)2.6g(2)1.335g(3)130mL
答案:(1)2.6g(2)1.335g(3)130mL
 解析:由图可知,NaOH、MgCl2、AlCl3三种固体溶于水时,NaOH过量,0.58g沉淀为Mg(OH)2,10mL盐酸用于中和过量NaOH,30mL-10mL=20mL盐酸和AlO2-反应生成Al(OH)3;最后加入的盐酸溶解Mg(OH)2和Al(OH)3沉淀。
解:(1)由
解析:由图可知,NaOH、MgCl2、AlCl3三种固体溶于水时,NaOH过量,0.58g沉淀为Mg(OH)2,10mL盐酸用于中和过量NaOH,30mL-10mL=20mL盐酸和AlO2-反应生成Al(OH)3;最后加入的盐酸溶解Mg(OH)2和Al(OH)3沉淀。
解:(1)由




 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol 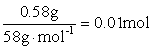 NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2- + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol,
NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2- + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol, 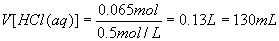
41. 答案:(1)
答案:(1) (2)a≥4b (3)3b<a<4b (4mb-ma)×10-3 mol
(2)a≥4b (3)3b<a<4b (4mb-ma)×10-3 mol
 解析:(1)当a≤3b时,AlCl3足量,生成Al(OH)3的量由NaOH溶液确定。
解析:(1)当a≤3b时,AlCl3足量,生成Al(OH)3的量由NaOH溶液确定。
 Al3+ + 3OH- ==== Al(OH)3↓
Al3+ + 3OH- ==== Al(OH)3↓
 3
1
3
1
 m×10-3×a mol x
m×10-3×a mol x
 x=
x=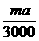 mol
mol
 (2)Al3+
+ 4OH-====AlO
(2)Al3+
+ 4OH-====AlO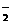 +2H2O
+2H2O
 1 4
1 4
 mb×10-3 mol ma×10-3 mol
mb×10-3 mol ma×10-3 mol
 所以4mb≤1ma a≥4b
所以4mb≤1ma a≥4b
 (3)当3b<a<4b,Al(OH)3沉淀达到最大值后,又溶解,溶液中无Al3+存在。
(3)当3b<a<4b,Al(OH)3沉淀达到最大值后,又溶解,溶液中无Al3+存在。
 n(Al(OH)3)=[mb-(ma-3mb)]×10-3 mol=(4mb-ma)×10-3 mol
n(Al(OH)3)=[mb-(ma-3mb)]×10-3 mol=(4mb-ma)×10-3 mol
40. 答案:⑴0.06 mol,440 mL。⑵400 mL。 ⑶
答案:⑴0.06 mol,440 mL。⑵400 mL。 ⑶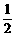 ≤a<1。
≤a<1。





 解析:⑴由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、
解析:⑴由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、
 Al反应的为H2SO4:0.2mol-0.16mol×=0.12mol。
Al反应的为H2SO4:0.2mol-0.16mol×=0.12mol。
 假设n(Mg)=x mol,n(Al)=y mol,
假设n(Mg)=x mol,n(Al)=y mol,
 则有方程组: 解得:
则有方程组: 解得:
 当加入V2 mL
NaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
当加入V2 mL
NaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
 Mg2+-2OH-,Al3+-4OH-,
Mg2+-2OH-,Al3+-4OH-,
 得:V2=160 mL+
得:V2=160 mL+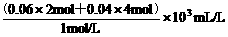 =440 mL。
=440 mL。
 ⑵当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,
⑵当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,
 关系式为2NaOH-H2SO4,得:V(NaOH)=
关系式为2NaOH-H2SO4,得:V(NaOH)=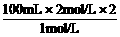 =400 mL。
=400 mL。
 ⑶当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:Na2SO4、NaAlO2。则根据Na元素守恒有:
⑶当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:Na2SO4、NaAlO2。则根据Na元素守恒有:
 n(NaOH)=0.45 L×1mol/L≥0.1 L×2
mol/L×2+0.1×(1-a)mol。
n(NaOH)=0.45 L×1mol/L≥0.1 L×2
mol/L×2+0.1×(1-a)mol。
 解得a≥
解得a≥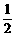 ,则满足此条件的a的取值范围是
,则满足此条件的a的取值范围是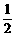 ≤a<1。
≤a<1。
39. 答案:(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
答案:(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
 (2)Fe(OH)3
Al(OH)3
(2)Fe(OH)3
Al(OH)3
 (3)Na2SO4
(3)Na2SO4
 (4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
(4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
 ②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
 解析:浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率。硫酸浸出液经过滤,滤液中主要溶质是MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3
Al(OH)3,此时滤液中阴离子主要是SO42-,加入NaOH后Mg2+完全沉淀,溶质主要成分是Na2SO4;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行;同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。
解析:浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率。硫酸浸出液经过滤,滤液中主要溶质是MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3
Al(OH)3,此时滤液中阴离子主要是SO42-,加入NaOH后Mg2+完全沉淀,溶质主要成分是Na2SO4;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行;同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com