
题目列表(包括答案和解析)
27. 答案:A
答案:A
 解析:酸雨的形成,主要与SO2的排放有关;光化学烟雾的形成,主要与烃类及氮氧化物有关;温室效应主要与烃类和CO2等有关
解析:酸雨的形成,主要与SO2的排放有关;光化学烟雾的形成,主要与烃类及氮氧化物有关;温室效应主要与烃类和CO2等有关
26. 答案:C
答案:C
 解析:对教材中工业生产中典型设备的结构(包括进出口方向)、原理及发生的反应必须有足够的重视。通入接触室的气体主要是SO2和O2,经过热交换后从A处流出,然后才能接触催化剂,反应后的气体经过内管又从下口通出。故A处流出的气体仍为SO2和O2。
解析:对教材中工业生产中典型设备的结构(包括进出口方向)、原理及发生的反应必须有足够的重视。通入接触室的气体主要是SO2和O2,经过热交换后从A处流出,然后才能接触催化剂,反应后的气体经过内管又从下口通出。故A处流出的气体仍为SO2和O2。
25. 答案:C
答案:C
 解析:硒和硫同属氧族元素,但硒的核电荷数,原子半径都比硫大,这两种元素除化学性质相似外,硒的非金属性比硫弱,据此可作 硫在空气中燃烧生成二氧化硫;与钠能组成化合物Na2S;硫化氢有臭鸡蛋气味,有剧毒;硫化氢在空气充足时燃烧生成二氧化硫和水,在空气不足时燃烧生成硫单质和水;亚硫酸为中强酸
解析:硒和硫同属氧族元素,但硒的核电荷数,原子半径都比硫大,这两种元素除化学性质相似外,硒的非金属性比硫弱,据此可作 硫在空气中燃烧生成二氧化硫;与钠能组成化合物Na2S;硫化氢有臭鸡蛋气味,有剧毒;硫化氢在空气充足时燃烧生成二氧化硫和水,在空气不足时燃烧生成硫单质和水;亚硫酸为中强酸 而硒的非金属性比硫弱,所以硒化氢比硫化氢易分解,亚硒酸的酸性比亚硫酸弱,应是弱酸
而硒的非金属性比硫弱,所以硒化氢比硫化氢易分解,亚硒酸的酸性比亚硫酸弱,应是弱酸
24. 答案:CD
答案:CD
 解析:本题解题的关键在于搞清楚Se与O、S、Cl、Br等元素在元素周期表中的相对位置关系及Se单质和臭氧的特殊性质。如Se可作为半导体材料,臭氧是很强的氧化剂等。另外元素周期律的知识是判断选项正误的钥匙。
解析:本题解题的关键在于搞清楚Se与O、S、Cl、Br等元素在元素周期表中的相对位置关系及Se单质和臭氧的特殊性质。如Se可作为半导体材料,臭氧是很强的氧化剂等。另外元素周期律的知识是判断选项正误的钥匙。
 Se位于元素周期表的第ⅥA族,最外层为6个电子,故最高价为+6价,最低价为-2价,因此最高价氧化物的形式为SeO3。再由于Se原子半径较S原子的大,故体现部分金属性质。硒可作为半导体材料。因此选项A、B都正确。
Se位于元素周期表的第ⅥA族,最外层为6个电子,故最高价为+6价,最低价为-2价,因此最高价氧化物的形式为SeO3。再由于Se原子半径较S原子的大,故体现部分金属性质。硒可作为半导体材料。因此选项A、B都正确。
 根据O、S、Cl、Br与Se在元素周期表中的相对位置关系,运用元素周期律的知识不难判断出原子半径大小关系为:Se>S、Se>Br;单质的氧化性的关系为O3>O2>S>Se、Cl2>Br2>Se,因此可判断C、D两选项中的部分判断存在错误。
根据O、S、Cl、Br与Se在元素周期表中的相对位置关系,运用元素周期律的知识不难判断出原子半径大小关系为:Se>S、Se>Br;单质的氧化性的关系为O3>O2>S>Se、Cl2>Br2>Se,因此可判断C、D两选项中的部分判断存在错误。
23. 答案:C
答案:C
 解析:标准状况下,SO2是气体,SO3是固体,不可能具有相同的体积,①错。SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有还原性,②错。等物质的量SO2和Cl2混合后发生反应:SO2+Cl2+2H2O
解析:标准状况下,SO2是气体,SO3是固体,不可能具有相同的体积,①错。SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有还原性,②错。等物质的量SO2和Cl2混合后发生反应:SO2+Cl2+2H2O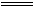 H2SO4+2HCl,不能使品红褪色,③错。SO2通入Ba(OH)2溶液中,生成BaSO3沉淀,加入稀硝酸转化为BaSO4沉淀,⑤错。
H2SO4+2HCl,不能使品红褪色,③错。SO2通入Ba(OH)2溶液中,生成BaSO3沉淀,加入稀硝酸转化为BaSO4沉淀,⑤错。
22. 答案:B
答案:B 





 解析:不溶于盐酸的沉淀质量为2.33
g,应是BaSO4,可见100
mL溶液中含SO42-0.01mol,溶于盐酸的沉淀是BaCO3,质量为6.27g-2.33g=3.94g,可见100
mL溶液中含CO32-0.02mol。溶液中含CO32-和SO42-,故Mg2+和Ba2+肯定不存在,因Mg2+和Ba2+肯定不存在,故肯定存在K+。加入AgNO3溶液有白色沉淀产生不一定是Cl- ,故Cl-不一定存在。
解析:不溶于盐酸的沉淀质量为2.33
g,应是BaSO4,可见100
mL溶液中含SO42-0.01mol,溶于盐酸的沉淀是BaCO3,质量为6.27g-2.33g=3.94g,可见100
mL溶液中含CO32-0.02mol。溶液中含CO32-和SO42-,故Mg2+和Ba2+肯定不存在,因Mg2+和Ba2+肯定不存在,故肯定存在K+。加入AgNO3溶液有白色沉淀产生不一定是Cl- ,故Cl-不一定存在。
21. 答案:A
答案:A
 解析:SO2有还原性,Fe(NO3)3有氧化性,发生反应:2Fe3++SO2 +2H2O
解析:SO2有还原性,Fe(NO3)3有氧化性,发生反应:2Fe3++SO2 +2H2O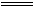 2Fe2++
2Fe2++
 SO42-+4H+。
SO42-+4H+。
20. 答案:CD
答案:CD
 解析:结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;
解析:结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;
 2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,
2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,
 H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
19. 答案:B
答案:B
 解析:S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错
解析:S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错
18. 答案:AD
答案:AD
 解析:用pH试纸检验溶液的pH大于7,说明溶液中含水解显碱性的离子SO32-;向溶液中滴加氯水,再加入CCl4振荡,静置呈橙色,说明溶液中含Br-;加入Ba(NO3)2溶液和稀HNO3,有不溶于稀HNO3的白色沉淀产生,说明溶液中含SO42-,但SO42-可能是原溶液中含有的,也可能是SO32-氧化生成的;向滤液中加入AgNO3溶液和稀HNO3,有不溶于稀HNO3的白色沉淀产生,因已加入氯水,故不能确定原溶液中是否含有Cl-。
解析:用pH试纸检验溶液的pH大于7,说明溶液中含水解显碱性的离子SO32-;向溶液中滴加氯水,再加入CCl4振荡,静置呈橙色,说明溶液中含Br-;加入Ba(NO3)2溶液和稀HNO3,有不溶于稀HNO3的白色沉淀产生,说明溶液中含SO42-,但SO42-可能是原溶液中含有的,也可能是SO32-氧化生成的;向滤液中加入AgNO3溶液和稀HNO3,有不溶于稀HNO3的白色沉淀产生,因已加入氯水,故不能确定原溶液中是否含有Cl-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com