
题目列表(包括答案和解析)
37. 答案:BD
答案:BD
 解析:充分反应后,质量增加的1.6 g必为参加反应的硫的质量,则n(S)=
解析:充分反应后,质量增加的1.6 g必为参加反应的硫的质量,则n(S)=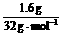

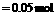 ,说明:n(单质):n(S)=0.1
mol∶0.05 mol=2∶1。分析四个选项,符合该反应物质的量之比(2∶1)的,只有Cu和K,2Cu+S
,说明:n(单质):n(S)=0.1
mol∶0.05 mol=2∶1。分析四个选项,符合该反应物质的量之比(2∶1)的,只有Cu和K,2Cu+S Cu2S,2K+S
Cu2S,2K+S K2S。
K2S。
36. 答案:A
答案:A





 解析:本题考查了氧化还原反应的条件的重要性。Cu和H2SO4反应的前提条件是浓H2SO4,开始18mol/L为浓的,但随着Cu参加反应,H2SO4被消耗变稀,此时反应已终止。其次,考查了氧化性酸在与金属发生反应时,其作用分两部分:一部分充当氧化剂,使其得电子数与金属失电子数相同,另一部分是生成的金属阳离子与酸根结合生成盐。由Cu+2H2SO4=Cu SO4+SO2↑+2H2O可知如果H2SO4完全反应,也只有一半充当氧化剂被还原,故被还原18mol/L H2SO4的最大量为(18mol/L×0.05L)÷2=0.45mol。
解析:本题考查了氧化还原反应的条件的重要性。Cu和H2SO4反应的前提条件是浓H2SO4,开始18mol/L为浓的,但随着Cu参加反应,H2SO4被消耗变稀,此时反应已终止。其次,考查了氧化性酸在与金属发生反应时,其作用分两部分:一部分充当氧化剂,使其得电子数与金属失电子数相同,另一部分是生成的金属阳离子与酸根结合生成盐。由Cu+2H2SO4=Cu SO4+SO2↑+2H2O可知如果H2SO4完全反应,也只有一半充当氧化剂被还原,故被还原18mol/L H2SO4的最大量为(18mol/L×0.05L)÷2=0.45mol。
35. 答案:C
答案:C
 解析:H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
解析:H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
 如为情况①,说明H2S过量。
如为情况①,说明H2S过量。
 则由:2H2S+O2=2H2O+2S体积减少
则由:2H2S+O2=2H2O+2S体积减少
 2 1
3
2 1
3
 60
30
100-10=90
60
30
100-10=90
 参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
 若为情况②或③,说明O2过量。
若为情况②或③,说明O2过量。

 则由:2H2S+3O2=2H2O+2SO2体积减少
则由:2H2S+3O2=2H2O+2SO2体积减少
 2 3
2 3
2 3
2 3
 60 90 90
60 90 90
 则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
34.
 答案:C
答案:C
 解析:
解析: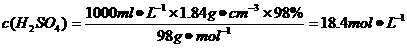 ,故A错;Cu与浓硫酸反应:Cu+2H2SO4(浓)
,故A错;Cu与浓硫酸反应:Cu+2H2SO4(浓) 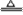 CuSO4+SO2↑+2H2O,随着反应进行,浓H2SO4会变成稀H2SO4,反应停止,得到SO2气体体积小于10.3 L,B错;浓H2SO4与等体积的水混合所得溶液的质量分数大于49%,D错。
CuSO4+SO2↑+2H2O,随着反应进行,浓H2SO4会变成稀H2SO4,反应停止,得到SO2气体体积小于10.3 L,B错;浓H2SO4与等体积的水混合所得溶液的质量分数大于49%,D错。
33. 答案:AD
答案:AD
 解析:2H2S
+O2
解析:2H2S
+O2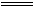 2S↓+2H2O,pH变大直至7;2H2SO3+O2
2S↓+2H2O,pH变大直至7;2H2SO3+O2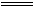 2H2SO4,pH变小;H2S
+Cl2
2H2SO4,pH变小;H2S
+Cl2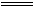 S↓+2HCl,pH变小;SO2+Cl2+2H2O
S↓+2HCl,pH变小;SO2+Cl2+2H2O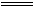 H2SO4+2HCl,pH变小。
H2SO4+2HCl,pH变小。
32.
 答案:AB
答案:AB
 解析:n(Fe)=n(气体)=
解析:n(Fe)=n(气体)= =0.1 mol。如果0.1 mo1气体为H2,其质量为0.2 g;如果0.1 mol气体为H2S,其质量为3.4 g,故A和B均对;如果n(S)> n (Fe)=0.1 mol,则原混合物的质量大于8.8 g,故C错;如果n(S)=n(Fe),则原混合物加热反应后的物质为纯净物,否则为混合物。
=0.1 mol。如果0.1 mo1气体为H2,其质量为0.2 g;如果0.1 mol气体为H2S,其质量为3.4 g,故A和B均对;如果n(S)> n (Fe)=0.1 mol,则原混合物的质量大于8.8 g,故C错;如果n(S)=n(Fe),则原混合物加热反应后的物质为纯净物,否则为混合物。
31. 答案:C
答案:C
 解析:少量浓硫酸与Na2SO3晶体反应产生SO2气体,依次通过湿润淀粉KI试纸(不反应)、沾有KMnO4溶液滤纸(不是由于其漂白性,而是因为其还原性,被KMnO4溶液氧化)、品红试纸(褪色:SO2漂白性)。SO2不能漂白酸碱指示剂,故不能使蓝色石蕊试纸褪色。
解析:少量浓硫酸与Na2SO3晶体反应产生SO2气体,依次通过湿润淀粉KI试纸(不反应)、沾有KMnO4溶液滤纸(不是由于其漂白性,而是因为其还原性,被KMnO4溶液氧化)、品红试纸(褪色:SO2漂白性)。SO2不能漂白酸碱指示剂,故不能使蓝色石蕊试纸褪色。
30. 答案:D
答案:D
 解析:SO2和SO3通入氯化钡溶液,只有硫酸钡沉淀,因为亚硫酸钡溶于稀硫酸
解析:SO2和SO3通入氯化钡溶液,只有硫酸钡沉淀,因为亚硫酸钡溶于稀硫酸
29. 答案:D
答案:D 





 解析:K2SO4和K2SO3中K和S元素的质量比均为39∶16,不能推测该粉末为纯净物,A错。加入氯化钡,也可生成K2SO3白色沉淀,B错。将粉末加入盐酸中,产生气泡,只能证明原粉末有K2SO3,不能原粉末只有K2SO3,C错。
解析:K2SO4和K2SO3中K和S元素的质量比均为39∶16,不能推测该粉末为纯净物,A错。加入氯化钡,也可生成K2SO3白色沉淀,B错。将粉末加入盐酸中,产生气泡,只能证明原粉末有K2SO3,不能原粉末只有K2SO3,C错。
28. 答案:B、D
答案:B、D
 解析:在反应①中NO2起氧化剂的作用,从反应①、③看NO2起催化作用,选项A中浓硫酸起吸水剂的作用;选项B中浓硫酸起氧化剂作用;选项C中浓硫酸起酸性作用;选项D中浓硫酸起催化剂作用
解析:在反应①中NO2起氧化剂的作用,从反应①、③看NO2起催化作用,选项A中浓硫酸起吸水剂的作用;选项B中浓硫酸起氧化剂作用;选项C中浓硫酸起酸性作用;选项D中浓硫酸起催化剂作用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com