
题目列表(包括答案和解析)
18.2008年北京奥运会“祥云”奥运火炬所用环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5 kJ·mol-1;正丁烷的燃烧热为:2878kJ·mol-1;异丁烷的燃烧热为:2869kJ·mol-1。下列有关说法正确的是
A.丙烷燃烧的热化学方程式可表示为:
C3H 8(g)+5O2(g)=3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
8(g)+5O2(g)=3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
B.正丁烷燃烧的热化学方程式可表示为:
2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);ΔH= -2878 kJ·mol-1
-2878 kJ·mol-1
C.正丁烷转化为异丁烷的过程是一个放热过程
D.正丁烷比异丁烷稳定
17.做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→C O2↑+Mn2++□(未配平)。关于此反应的叙述正确的是
O2↑+Mn2++□(未配平)。关于此反应的叙述正确的是
A.该反应的氧化剂是H2C2O4
B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH-
D.配平该反应后,H+的计量数是6
16.下列用来表示物质变化的化学用语中,错误的是
A.钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-= 4OH-
B.向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+
C.1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:()
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1); H=-114.6kJ·mol-1
H=-114.6kJ·mol-1
D.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:
SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O
15.在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
14.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。

实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是
A.钠着火燃 烧产生苍白色火焰
烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.管右端棉球外颜色变化 可判断氯
可判断氯 气是否被碱液完全吸收
气是否被碱液完全吸收
13.实验室常用MnO2与浓盐酸共热制取C12,也可用KC1O3、KMnO4、K2Cr2O7代替MnO2
与浓盐酸反应制C12,其中KClO3→Cl2 KMnO4→Mn2+ K2Cr2O7→Cr3+。若制取等量
的C12,电子转移数最少是
A.MnO2 B. KC1O3 C.KMnO4 D.K2Cr2O7
12.关于下列各装置图的叙述中,不正确的是
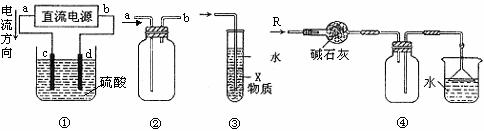
A.装置①中,c、d分别为石墨电极,则c极得到O2、d极得到H2
B.装置②可用于收集NO气体
C.装置③中X若为四氯化碳,可用于吸收氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11.设阿伏加德罗常数的值为NA,下列叙述正确的是
A.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
B.0.1mol 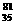 Br原子中含中子数为3.5NA
Br原子中含中子数为3.5NA
C.6.0g SiO2晶体中含有的硅氧键数目为0.4NA
D.7.8g过氧化钠中所含有的阴离子数为0.2NA
10.右图a曲线是198K时N2与H2反应过程中能量变化的示意图。下列叙述正确的 是
是
A.该反应的热化学方程式为:[()
N2 + 3H2 2NH3 △H =-92kJ·mol-1
2NH3 △H =-92kJ·mol-1
B.向一密闭容器中加入1molN2和3molH2充分
反应后,放出92kJ热量
C.b曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速度,降低逆反应速率
9.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③17.6g CO2 ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ()
a.体积②>③>①>④ b.密度③>②>④>①
c.电子总数②>③>①>④ d.原子总数①>③>②>④
A.abcd B.bcd C.acd D.abc
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com