
题目列表(包括答案和解析)
2.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解 熔融的氯化物制得的
熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
1.下列物质与其用途相符合的是
①N2-保护气 ②SiO2-光导纤维
③AgI-人工降雨 ④碘-预防甲状腺肿大
⑤Al2O3-耐火材料 ⑥NaClO-消毒剂
A.②③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.全部
25.(5×2’=10’)某化学研究性小组同学提出回收含铜电缆废料中提取铜的两种方案,并向专家咨询,专家就以下几个方面与同学们展开讨论:
方案甲:


方案乙:


(1)两个方案哪个符合当前生产的绿色理念,为什么?
。.
(2)方案甲中的②③步骤与铜有关的反应是离子反应吗?若是,写出离子方程式。
② ___ ③_________ _____ _________。
(3)专家建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是: 。
(4)专家请同学们用简便的方法检验红色粉末中是否含有过量的铁屑,同学们运用所
福建省闽江学院附属中学2010届高三上学期期末模拟
24.(5×2’ +2×3’=16’)某同学用如图所示的装置来探究SO2的性质及有关实验。
(1)实验前应先检验装置的气密性,方法是
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出化学方程式 。(3’)
(3)将制取的SO2气体通入C溶液中,请回答下列问题:
①若C溶液是紫色石蕊试液,通入少量SO2气体后,现象是 ,继续通入过量的SO2气体,现象是 。
②若C溶液是橙色的溴水溶液,通入SO2气体后现象 ,写出反应的离子方程式 。(3’)
③若C溶液是澄清石灰水,缓慢且持续通入SO2气体过程中,观察到的现象是 。
23.(09年海南化学·15)(6×2’=12’)
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =4LiCl+S +SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
 (4)组装该电池须在无水、无氧的条件下进行,原因是
。
(4)组装该电池须在无水、无氧的条件下进行,原因是
。
22.(4×2’+2×3’=14’)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO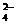 、NO
、NO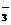 、OH-、CO
、OH-、CO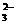 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由 。(3’)
(2)写出其余几种物质的化学式:A B C
(3)实验②中有关反应的离子方程 。(3’)
21.(4×2’=8’)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a. MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
20.(09年海南化学·12)已知:
Fe2O2(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是
A.-824.4kJ·mol- B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
第Ⅱ卷
19.(09年上海化学·14)根据以下事实得出的判断一定正确的是
A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
18. R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数) ( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com