
题目列表(包括答案和解析)
2.在含有Cu(NO3)2.Zn(NO3)2 Fe(NO3)3.AgNO3各0.1mol的混合溶液中加入0.1mol Fe粉,充分搅拌后铁溶解,溶液中不存在Fe3+离子,同时析出0.1molAg。则下列结论中不正确的是 ( )
A.溶液中Cu2+与Fe2+的物质的量之比为1:2
B.氧化性:Ag+>Cu2+>Fe3+>Zn2+
C.Fe3+的氧化性大于Cu2+
D.1molFe可还原2molFe3+
1.下列离子方程式正确的是 ( )
A.过量的NaHSO4和Ba(OH)2溶液反应:H+ + SO42- + Ba2+ + OH- == BaSO4↓ +2H2O
B.NH4HCO3和过量NaOH溶液相混合:HCO3- + OH- == CO32- + H2O
C.NaHSO4溶液中滴加NaHCO3溶液:H+ + HCO3- == H2O + CO2↑
D.用氨水吸收少量的SO2:NH3 + H2O + SO2 == NH4+ + HSO3-
23、(8分)amol某单质M与含bmol1HNO3的溶液恰好完全反应。
(1)若M为Cu,则被还原的HNO3的物质的量一定是______________mol。(用含ab的式子表示)
(2)若a=0.6,M仍为Cu,充分反应后,共收集剑标况下的气体22.4L,则此时b=______
(3)若M为Mg,b=1,已知反应中转移了0.8mol的电子,则硝酸的还原产物可能是____
(4)若M为Fe,且a:b=l:3,若HNO3被还原为NO,则Fe最终生成____________
A.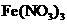 B.
B.


C.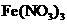 和
和 D.无法判断
D.无法判断

22、(6分)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾)溶液,会发生如下反应:
该反应常用于检验Mn2+的存在。其特征现象是____________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为___________mol。若该反
应所用的硫酸锰改为氯化锰,当它跟过量的过二硫酸钾反戍时,除有高锰酸钾、硫酸钾、
硫酸生成外,其他的,上成物还有_________________
21、(8分)有一包白色固体A,可能含有FeCl3、CaCO3、NaOH、Ba(OH)2、BaCl2、
Na2SO4中的几种,取少量A做如下实验,现象如图所示。试用化学式填空:
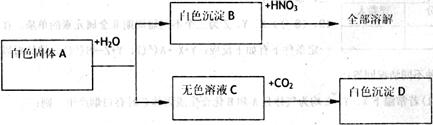
(1)白色沉淀B是__________________D是_________________:
(2)白色同体A 中一定不存在的物质为_________________;
(3)若白色同体A中只含二种物质,它们是_____________________:
(4)白色固体A还有哪些可能的组成(可不填满):
①__________________ ②_______________ ③_________________
④__________________ ⑤________________
20、(9分)W、X、Y、Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻。已知W元素的氧化物与Z元素的氧化物反应只生成一种盐a;X、Y位于同一族,它们能组成YX2、YX3两种常见化合物。请回答下列问题: 

(1)Y元素在周期表中的位置是__________________
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是_____________(填化学式):
(3)W元素氧化物的空间构型为_____________,X元素氡化物的结构式____________,
Y元素氢化物属____________分子(填极性或非极性)
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为__________________________;
(5)a溶液的pH________________________(填“>”、“<”或“=”)7,用离子方程式解
释___________________________________________。
19、(8分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是______________;
②生成同体C的化学方程式是_____________________________________
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是_______________;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是___________________________________________;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的离子方程式是___________________________________________。
18、(10分)现有A、B、C、D、E五种物质,并存在如下转化关系,其中E为黑色粉末。 

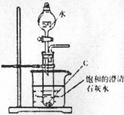
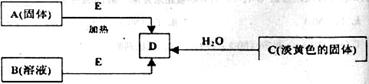
I、利用右图所示的实验装置进行C与水的反应,
回答下列有关问题:
(1)将分液漏斗中的水滴入试管,然后:
①在导管口处检验生成气体的方法是________________________________________
②观察烧杯中的现象为:__________________
产生此现象的原因是___________________________________________________________
(2)已知水与C反应生成D及另一种化合物F,在通常状况下,足量F的稀溶液与含溶质为1mol的稀盐酸完全反应时放出a kJ的热量,请写出该反应的热化学方程式_________
________________________________________________________________。

II、在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X。为检验X的性质,设计如上图所示的实验装置:
(1)请写出此实验中制备单质气体X的离子反应方程式
____________________________________________
(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,你认为应该如何改进?___________________。
(3)实验结束后,装置Ⅳ中可观察到现象是__________________________,若滴加两滴胶头滴管中的试剂,观察到溶液呈红色,胶头滴管中的试剂为:__________
17.有一碱性溶液250mL,它可能是NaOH、Na2CO3、 NaHCO3,中的一种或两种,若加入足量的盐酸,产生的气体用Ba(OH)2溶液吸收,可得14.775g的白色沉淀物,另取同样体积的该碱性溶液,恰能使浓度为0.625mol/L的NaOH溶液100mL完全反应,该碱溶液的可能组成是
A. 、
、 B.
B. 、
、 C.只含
C.只含 D.只含
D.只含
第II卷(共49分)
16.X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y能形成化合物M。下列说法正确的是
A.若M属于离子晶体,则其中可能含有非极性键
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y两元素周期数差l,则属于离子化合物的M只有四种
D.若X、Y处于同一周期,则化合物M不可能是非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com