
题目列表(包括答案和解析)
43.(14分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元 素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E是邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素? ,推断依据是 。
(2)根据题目提供的条件,推断E在周期表中的族序数(用必要的文字说明)
。
(3)向甲的水溶液加入MnO2,反应的化学方程式: 。
(4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?(用化学方程式表示) 。
(5)丙是水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(6)向30mL 1mol/LKI溶液中依次注入下列试剂:
①1mL 5mol/L盐酸 ②0.5mol/L 30% 甲溶液 ③1 mL丁。
经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是 。
贵州省乌沙中学09-10学年高三上学期期中考试
42.(8分)有X、Y、Z三种元素,已知:
① X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
② Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答:
⑴ Z的基态原子的电子排布式为 。
⑵ 将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 。
⑶ X单质在空气中燃烧生成一种无色有刺激性气味的气体。
① 已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 molO2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 。
② 原无色有刺激性气味的气体与含1.5 molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×10 23个电子转移时,该反应的化学方程式是 。
41.(8分)现有浓度均为0.100 mol·L-1的五种电解质溶液:① Na2CO3,② NaHCO3,③ NaAlO2,④ CH3COONa,⑤ NaOH。已知:CO2 + 2AlO2- + 3H2O = 2Al(OH)3↓+ CO32-
⑴ 这五种溶液的pH由小到大的顺序是 (填编号)。
⑵ 将五种溶液稀释相同倍数时,其pH变化最大的是 (填编号)。
⑶ 各取上述五种溶液25.00 mL,分别滴入0.100 mol·L-1 25.00 mL的HCl溶液,所得溶液pH最大的是 (填编号)。
⑷ 将上述① ② ③ ④ 四种溶液两两混合,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
40.(10分)请按要求填空:
(1)下列实验操作或对实验事实的叙述中存错误的是 (填序号)
A.用50mL酸式滴定管准确量取25.00mL酸性KMnO4溶液,放入锥形瓶中待用
B.在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C.中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D.实验室中进行的下列实验需水浴加热:①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备
E.配制1mol·L-1的NaOH溶液时,下列操作造成所配浓度偏低:①溶解后烧杯未多次洗涤②定容时仰视刻度线③容量瓶中原有少许蒸馏水
 F.实验室配制氯气亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
F.实验室配制氯气亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
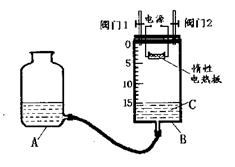
(2)某同学设计了如图所示测定红磷在氯
气中燃烧产物的分子式的装置,该装
置中B是底面积为100cm2的圆筒状
玻璃容器(密封盖上装有阀门),上
面标有厘米单位的刻度,其它夹持
装置已略去。
操作步骤:
①检查装置的气密性。
②将0.5g红磷平铺在电热板上,盖紧容器。
③打开阀门1、阀门2,从A的瓶口加入液体C,使B中液面至刻度15.0cm。
④向B中充入氯气,待氯气充满后关闭阀门1、阀门2,通电加热红磷。……
请回答下列问题:
(i)检查装置气密性具体方法是 。
(ii)实验步骤③加入的液体C是 (填名称)。
(iii)反应结束并充分冷却后,读取B中液面刻度读数时,应注意:
;
若液面在刻度5.6cm处,此时实验条件近似看作标准状况,则生成物PC1x中x的值是 (计算结果保留1位小数)。
38.(9分) 水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与 、
、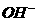 的浓度关系如下图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(
的浓度关系如下图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(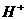 ),pCl=一lgc(
),pCl=一lgc( )]。
)]。
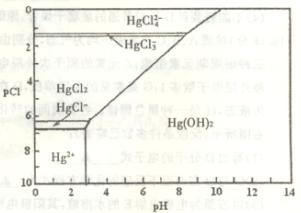
(1)正常海水(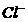 的浓度大于0.1mol/L) 中汞元素的主要存在形态是
。
的浓度大于0.1mol/L) 中汞元素的主要存在形态是
。
少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示) ,为了防止出现浑浊,可采取的措施是 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含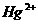 的废水。反应的离子方程式为
。
的废水。反应的离子方程式为
。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知
Ksp(HgS)=1.6×10-52(mol/L)2,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= 。
37.(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
⑴ 写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
⑵ 若将⑴中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
⑶ 腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.01 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤: ① ;② ;③ 。
氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pH
Cu2+ 4.7 6.7
Fe2+ 7.0 9.0
Fe3+ 1.9 3.2
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu
⑷ 某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选)设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式: , 。
劣质不锈钢腐蚀的实验现象 。
36.(8分)“碘钟”实验中,3I- + S2O82- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间 t 来度量,t 越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol•L-1 0.040 0.080 0.080 0.160 0.120
c(S2O82-)/mol•L-1 0.040 0.040 0.080 0.020 0.040
t / s 88.0 44.0 22.0 44.0 t1
回答下列问题:
⑴ 该实验的目的是 。
⑵ 显色时间t1 = 。
⑶ 温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A. < 22.0 s B. 22.0 s - 44.0 s C. > 44.0 s D. 数据不足,无法判断
⑷ 通过分析比较上表数据,得到的结论是 。
35. 下述说法中正确的是( )
A. 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B. 常温常压下,只有一种元素的单质呈液态
C. 同一周期元素的原子,半径越小越容易失去电子
D. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
第Ⅱ卷(非选择题 共80分)
34. 已知:CH3CH2CH2CH3(g)+ 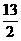 O2(g)= 4CO2(g)+
5H2O(l) ΔΗ = -2878
kJ·mol-1
O2(g)= 4CO2(g)+
5H2O(l) ΔΗ = -2878
kJ·mol-1
(CH3)2CHCH3(g)+ 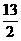 O2(g)= 4CO2(g)+
5H2O(l) ΔΗ = -2869
kJ·mol-1
O2(g)= 4CO2(g)+
5H2O(l) ΔΗ = -2869
kJ·mol-1
下列说法正确的是( )
A. 正丁烷转化为异丁烷的过程是一个吸热过程
B. 正丁烷分子储存的能量大于异丁烷分子
C. 正丁烷的稳定性大于异丁烷
D. 正丁烷分子中的碳氢键比异丁烷的少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com