
题目列表(包括答案和解析)
28.(13分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
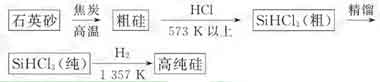
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,为什么会引起不良的后果 。
(2)下列有关硅材料的说法正确的是 (填字母)。
A、碳化硅化学性质稳定,可用于生产耐高温材料
B、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
C、盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
D、氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
E、高纯度二氧化硅可用于制造高性能通讯材料-光导纤维
(3) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,
通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s)+
6CO(g)
Si3N4(s)+
6CO(g)
该反应的氧化剂是 。
27.(7分)A、X、Y、Z是中学常见的单质和化合物。它们在一定条件下能发生如下转化,转化中的部分产物已省略。
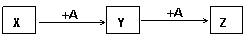
(1)若A为氧化性的单质,Z为淡黄色固体。则Z中阴阳离子个数的最简比是 ;如果将Z投入到含有少量酚酞的水溶液中可能出现的现象是 。
(2)若X为黑色非金属单质,A既是氧化物又是氢化物。写出X在一定条件下转化为Y的化学反应方程式: 。
26.(9分)A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)
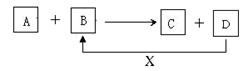
填写下列空白。
(1)若A为金属铝,B为氧化铁,写出反应A + B → C + D的一种用途 。
(2)若A、B、C、D都是化合物,其中A为H2O, B、C、D均含有氮元素,则B为
色气体。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,该反应的离子方程式为 。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是 。
25.(15分)有一可能含Cu2+、Al3+、Mg2+、Na+、Cl-、CO32-、SO42-的溶液。加入BaCl2产生白色沉淀;加入稀HCl溶液,没有气体产生;若加入Na2O2则有无色无味气体产生,并生成白色沉淀,加入Na2O2的量与生成白色沉淀量关系如图所示,则:
 (1)上述溶液中一定无
离子,
(1)上述溶液中一定无
离子,
可能有 离子,曲线BC说
明 离子肯定存在。
(2)加入Na2O2产生无色无味气体的化学
方程式为 ;
加入BaCl2产生白色沉淀的离子方程式为 ;
曲线B-C段所发生的反应的离子方程式为 。
24.(12分)短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C-离子的原子结构示意图 ;
(3)D元素的最高价氧化物的结构式是: ;
其分子内含有 键(填“极性”或“非极性”)
(4)0.8mol的D元素的最高价氧化物与含NaOH 1.0mol的水溶液反应,生成的正盐和酸式盐的物质的量之比为 。
23.(15分)某生利用物质间的互变,设计成一个平面魔方,如下图所示:
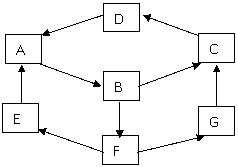
已知①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E、G。
③
|
|
纯A(单质) |
B溶液 |
C固体 |
D固体 |
G溶液 |
|
颜色 |
银白色 |
黄色 |
红褐色 |
红棕色 |
浅绿色 |
依据以上信息填空:
(1)请写出E、D的化学式 、 。
(2)请指出A、B、C、D、G所含的同种元素在周期表的位置_____________,
(3)G生成C的过程中所出现的现象为 ,
反应式________________________ 、 _________________________。
(4)写出反应E→A的化学方程式: ;
(5)B→F的离子方程式为 。
22.将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应生成N2的气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O3 C.N2O D.N2O4
第Ⅱ卷 非选择题(84分)
21.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
20.工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH3 3.50 L恰好反应完全,则混合气体中NO和NO2的体积分数比为
A.1:4 B.1:3 C.1:2 D.1:l
19. 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸
均褪色都能证明SO2的漂白性
C.湿润淀粉KI试纸未变蓝说明SO2
的氧化性强于I2
D.NaOH溶液可用于除去实验中多余的SO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com