
题目列表(包括答案和解析)
20.FeCl3可用作印刷电路铜板腐蚀剂。为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析。某同学取废腐蚀液200mL,分成甲、乙两等份。向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15g;向乙溶液中加入10g足量铁粉,充分反应,剩余固体质量4.8g。计算中忽略溶液体积的变化。
⑴写出FeCl3溶液腐蚀印刷电路铜板的离子方程式,并标出电子转移的方向和数目 。
⑵废腐蚀液中含有的Cl-离子的物质的量浓度是 。
⑶计算废腐蚀液中铜离子的物质的量浓度(写出计算过程)。
19.在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
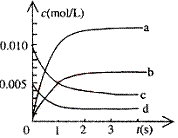 ⑵右图中表示NO2的变化的曲线是
。
⑵右图中表示NO2的变化的曲线是
。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
⑷某同学查阅资料得知,该反应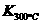 >
>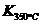 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
。
⑸ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
18.由白色和黑色固体组成的混合物A,可以发生如下框所示的一系列变化:


(1)写出反应①的化学方程式: 。
反应④的离子方程式: 。
(2)下列实验装置中可用于实验室制取气体G的发生装置是 (填序号)。
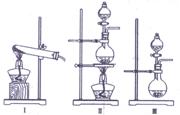
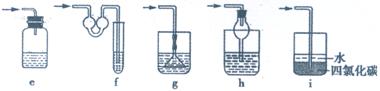
⑶为了得到纯净干燥的气体G,可将气体通入a和b装置,a、b两广口瓶中所装入的溶液依次是a: ,b: 。c、d装置不完整,请在图中补充完整。
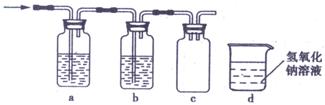
⑷气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出d中发生反应的的离子方程式: ;
⑸J是一种极易溶于水的气体,为了防止倒吸,下列e-i装置中,可用于吸收J的是 。
17.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤如下图所示:
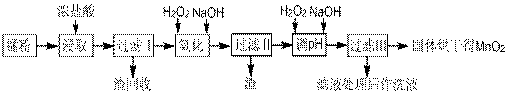

根据上图所示步骤并参考左边表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为 ;这种处理方法不足之处为: 。
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是__________________________。
(3)过滤I的滤渣的化学式为 。过滤Ⅱ的滤渣的化学式为 。
(4)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是: ,其目的是 。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为__________________________________________
16.已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是_____ _____;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物的沸点高低是______________并说明理由 。
15.粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 [设计除杂过程]
[设计除杂过程]
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 。
(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A.Na2CO3 B.Na2SO3 C.Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C,该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
14.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:C
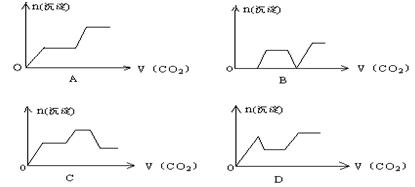
第II卷(非选择题 共58分)
13.下列有关溶液中各种离子浓度的关系错误的是
A.0.1mol·L-1NH4Cl溶液中:c(Cl-)+ c(OH-) =c(NH4+)+c(H+)
B.0.1mol·L-1NaHSO3溶液中:c(SO32-)+c(HSO3-)+c(H2SO3)=0.1mol·L-1
C.0.1mol·L-1KAl(SO4)2溶液中:c(SO42-)=c(Al3+)+c(K+)
D.足量铁屑溶于稀硝酸所得溶液中:c(NO3-)>c(Fe2+)>c(H+)>c(OH-)
12.膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如右图所示.下列有关芥子醇的说法正确的是
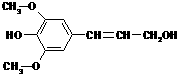 A.芥子醇的分子式是C11H14O4,属于芳香烃
A.芥子醇的分子式是C11H14O4,属于芳香烃
B.芥子醇分子中所有碳原子不可能在同一平面
C.芥子醇能与FeCl3溶液发生显色反应
D.芥子醇能发生的反应类型有氧化、取代、加成
11.下列离子方程式正确的是
A.硫化钠的水解反应:S2-+H3O+ HS-+H2O
HS-+H2O
B.在氯化亚铁溶液中加入稀硝酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O
 C.向Ca(HCO3)2溶液中加入少量的氢氧化钠溶液: Ca2++HCO3-+OH-=CaCO3↓ + H2O
C.向Ca(HCO3)2溶液中加入少量的氢氧化钠溶液: Ca2++HCO3-+OH-=CaCO3↓ + H2O
D.用铜为电极电解稀硫酸溶液: 2H2O O2↑ + 2H2 ↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com