
题目列表(包括答案和解析)
8.下列除去杂质的方法不正确的是
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
7.在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子。则下列判断正确的
A.混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的阳离子与阴离子的物质的量之比为1:3
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
6.标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂做喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A.1:1:1 B.5:5:4 C.2:1:2 D.无法确定
5. 下列叙述正确的是
A.金属钠着火,可用水扑灭
B.明矾水解形成胶体能吸附水中悬浮物,可用于水的净化
C.浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗
D.氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗
4.下列实验操作中错误的是
A.蒸发操作时,当有大量晶体析出时,才能停止加热
B.蒸馏操作时,应使温度计水银球浸在液面之下
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应使溶质在萃取剂中的溶解度远大于在水中的溶解度
3.下列关于纯净物、混合物、强电解质、电解质和非电解质的组合正确的是
|
|
纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
A |
青铜 |
水煤气 |
硫酸 |
醋酸 |
干冰 |
|
B |
铁红 |
盐酸 |
硫酸钡 |
亚硫酸 |
二氧化硫 |
|
C |
胆矾 |
碘酒 |
苛性钾 |
氢硫酸 |
碳酸钙 |
|
D |
明矾 |
漂白粉 |
氯化钠 |
次氯酸 |
氯气 |
2.将10 mL淀粉胶体和5 mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示),2 min后分别取袋内和烧杯内液体进行实验。下列说法正确的是
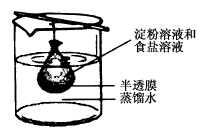 A.烧杯内液体加入硝酸银溶液后有白色沉淀产生
A.烧杯内液体加入硝酸银溶液后有白色沉淀产生
B.烧杯内液体加入碘水后呈蓝色
C.袋内液体加入硝酸银溶液后无变化
D.袋内液体加入碘水后不变蓝
1.下列叙述正确的是
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.国庆60周年放的烟花是某些金属元素焰色反应所呈现出来的色彩
22. (14分)某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2-、CO32-、SO42-中的若干种
离子组成,取该溶液进行如下实验:
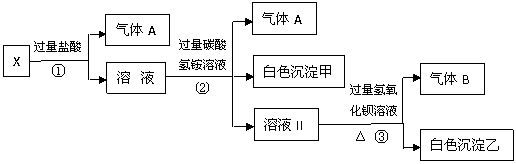 (1)气体A的成分是
(填化学式,下同),气体B的成分是
。
(1)气体A的成分是
(填化学式,下同),气体B的成分是
。
(2)写出步骤①发生反应的所有离子方程式 。
(3)写出步骤②形成白色沉淀甲的离子方程式 。
(4)通过上述实验,可确定X溶液中一定存在的离子是 ,
尚未确定是否存在的离子是 ,只要设计一个简单的后续实验就可以确
定该离子是否存在,该方法是 。
座位号 高三( )班 姓名
装 订 线
21. (13分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
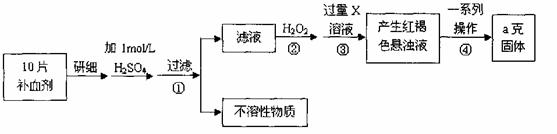 请回答下列问题:
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
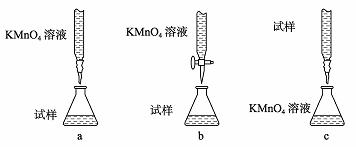
③某同学设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)
(6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg
FeSO4·7H2O的片剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com