
题目列表(包括答案和解析)
2.下列说法正确的是
A.吸热反应只有在点燃或加热条件下才能发生
B.燃料电池总反应一定是氧化还原反应,且一定是可自发进行的吸热反应
C.一个吸热的自发进行的反应一定是墒增大的反应
D.向10mL 0.1mol/LAgNO3溶液中滴加足量的NaCl溶液能够使Ag+浓度降到0 mol/L
1.下列关于化学基本概念和基本理论的几点认识中正确的是
A.原子是化学变化中的最小微粒,通过复杂的化学反应可以产生新的原子
B.有电子转移的过程不一定产生电流,但其化学反应一定是氧化还原反应
C.胶体区别于其他分散系的本质特征是具有丁达尔现象
D.强电解质溶液的导电能力一定强于弱电解质溶液
2.可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Al 27 S 32
Cl 35.5 K 39 Fe 56
第I卷(选择题)
本卷包括14小题,每小题3分,共42分。在每题列出的四个选项中,只有一项是最符合题目要求的
25. 按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极。
按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极。
(1)电极P极为 极
(2)a极上所发生的电极反应式为
。
(3)在标准状况下,b极产生气体的体积为 L
(4)c极上析出固体的质量为 g
24.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl = 2NaCl+H2O2 B.Ag2O+H2O2 =2Ag+O2↑+H2O
C.2H2O2 = 2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH = 2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2 仅体现氧化性的反应是(填代号,下同) 。
(2)述反应说明 H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
(3)保存过氧化氢试剂瓶上最适合贴上的一个标签是 (填序号);

(4)某强酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为 mol。
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O = A + NH3↑,试指出生成物A的化学式为 。
 (6)右图是实验室制取氧气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。某同学经过认真研究,借助生活中的某种建筑材料和二氧化锰创造性地解决了上述问题。你认为他的做法是
(6)右图是实验室制取氧气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。某同学经过认真研究,借助生活中的某种建筑材料和二氧化锰创造性地解决了上述问题。你认为他的做法是
。
23. 已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)Y的原子结构示意图是 、Z在周期表中的位置是
(2)X、Y、Z原子半径由大到小的顺序为 (用元素符号表示)
(3)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(4)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是 和
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是
22.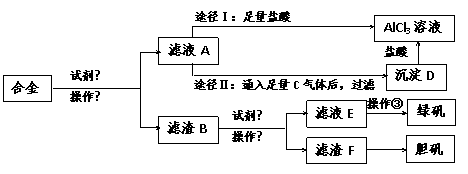 某工厂有废合金(含有铝、铁、铜)粉末,某校课外活动小组为了探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下
某工厂有废合金(含有铝、铁、铜)粉末,某校课外活动小组为了探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下
试回答下列问题:
(1)所加试剂①、②分别是 、 。
(2)操作①的名称为 ,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有 。
(3)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为合理的是_ ___,理由是____
。
写出A→D反应离子方程式: 。
(4)操作③的名称是_____ _____。
21. 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)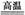 CO(g)+H2(g);
CO(g)+H2(g);
②C(s)、 CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)  CO2(g);ΔH=-393.5 kJ·mol-1
CO2(g);ΔH=-393.5 kJ·mol-1
H2(g)+  O2(g)
O2(g)  H2O(g);ΔH=-242.0 kJ·mol-1
H2O(g);ΔH=-242.0 kJ·mol-1
CO(g)+  O2
O2 CO2(g);ΔH=-283.0 kJ·mol-1
CO2(g);ΔH=-283.0 kJ·mol-1
请回答: (1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:
__________________ 。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
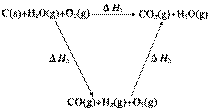
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________________(填“甲”或“乙”);判断的理由
是_______________________ 。
20. 配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为_________。
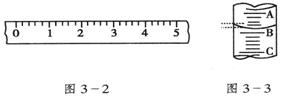
(2)某学生用托盘天平称量一个小烧杯的质量,假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),请用“↑”表示在托盘上放上砝码,“↓”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“︱”表示)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
取用砝码情况 |
|
|
|
|
|
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入20mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1-2 cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2-3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序__ __。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是___ ____。
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度
19.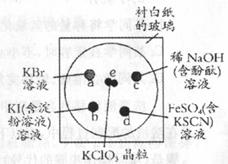 为了减少污染,使实验绿色化,微型实验备受青睐,下列操作是某学生做的一个微型实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各l滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。打开表面皿,向KCIO3晶体滴加一滴浓盐酸(氯酸钾与浓盐酸反应:
为了减少污染,使实验绿色化,微型实验备受青睐,下列操作是某学生做的一个微型实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各l滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。打开表面皿,向KCIO3晶体滴加一滴浓盐酸(氯酸钾与浓盐酸反应: ),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
a处 、
b处 、
c处 、
d处 、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com