
题目列表(包括答案和解析)
12.做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:
MnO4-+H2C2O4+H+→CO2↑+Mn2++ 。下列有关叙述正确的是
A.发生还原反应的是H2C2O4
B.该离子方程式右侧方框内的产物是OH
C.1 mol草酸分子中含有9 mol共用电子对
D.10 mol H+参加反应时,电子转移5 mol
|
11.对于某温度下平衡体系mA(g) + nB(g) pC(g) + qD(g) △H<0,下列说法不正确的是
pC(g) + qD(g) △H<0,下列说法不正确的是
A.若温度不变,将容器容积扩大到原来的2倍,此时A的浓度变为原来的0.52倍,则 m + n > p + q
B.向平衡体系中加入C、D,该反应的△H减小
C.若温度和容器体积不变,充入一定量的稀有气体,B的浓度不变
D.若平衡时,A、B的转化率相等,说明反应开始时,A、B物质的量之比为m∶n
10.已知酸H2B在水溶液中存在下列关系:
①H2B = H+
+ HB-,②HB-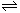 H+ + B2- ,则下列说法中一定不正确的是
H+ + B2- ,则下列说法中一定不正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.在Na2B溶液中一定有:c
(Na+)=2(c (B2-)+c
(HB-) + c (H2B) )
C.NaHB水溶液中一定有:c
(Na+) + c (H+) = c (HB-)
+ c (OH-) +2 c (B2-)
D.在Na2B溶液中一定有: c
(OH-)=c
(H+) + c (HB-)
9.如图所示,下列叙述正确的是
A.Zn为负极,被还原成Zn2+
B.SO42-有通过隔膜向Cu极运动的趋势
C.Y与滤纸接触处有氯气
D.Y为阴极,与滤纸接触处变红
8.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
C.元素X不能与元素Y形成化合物X2Y2
D.元素W、R的最高价氧化物的水化物都是强酸

7.下列说法或表示方法正确的是
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石) △H = +1.90 kJ/mol可知金刚石比石墨稳定
C.在200℃、101kPa时,1molH2与碘蒸气反应生成HI放热14.9kJ。该反应的热化学方程式为:H2(g)+I2(g)=2HI(g) △H =-14.9kJ/mol
D.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,表示氢气燃烧的热化学方程式表示为:2H2(g)+ O2(g)= 2H2O(l) △H =-285.8 kJ/mol
6.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入CO2气体,只能生成HX和NaHCO3;向NaY溶液中通入CO2,则生成HY和Na2CO3。下列有关叙述正确的是
A.酸性由强到弱:H2CO3>HX>HY
B.结合H+能力:CO32->Y->X->HCO3-
C.同浓度的NaX和 NaY溶液的pH前者大
D.向NaX溶液中通入足量CO2后的离子浓度:
c(X-)>c(Na+)>c(HCO3-)>c(OH-)
5.设阿伏加德罗常数的数值为NA ,下列说法正确的是
A.1 mL 1 mol·L-1 FeCl3溶液滴入沸腾的水中,所得胶体的粒子数为0.001NA
B.15.6g 过氧化钠与二氧化碳反应时,转移的电子数为0.4NA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
D.t℃时,pH =6 的纯水中,含10-6NA个OH-
4.某无色溶液中只可能含有Na+ 、Ba2 +、 Cl一、 Br一、SO32一、SO42一中的几种离子,对该溶液进行下列实验,实验操作和现象如下表: 
|
步骤 |
操 作 |
现 象 |
|
(1) |
取少量溶液滴加几滴石蕊试液 |
溶液变蓝 |
|
(2) |
另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 |
上层无色,下层呈橙红色 |
|
(3) |
取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 |
有白色沉淀产生 |
|
(4) |
向(3)的滤液中加入过量AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是 
A.肯定含有 Na+、 Br一、SO32一
 B.肯定没有 Ba2 +、Cl一、Br一
B.肯定没有 Ba2 +、Cl一、Br一

C.不能确定 Na+ 、 SO32一、SO42一 D.只含有 Cl一、 SO32一、SO42一
3.在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示原子。下列说法中正确的是
A.32S与33S的核外电子数相等,是同一种核素
B.13C和15N原子核内的质子数相差2
C.1H216O和 1H218O均能与金属钠剧烈反应
D.2H+的酸性比1H+的酸性更强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com