
题目列表(包括答案和解析)
11.2t m(CO)×80% m(H2)×80% m(HOCH2CH2CHO)
则m(CO)=14 t m(H2)=1.0 t m(HOCH2CH2CHO) =29.6 t
反应③中 HOCH2CH2CHO - H2
74 2
6.(10分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K= 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
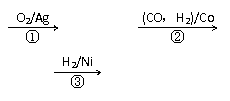 CH2=CH2
CH2=CH2
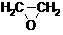
 HOCH2CH2CHO
HOCH2CH2CHO HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O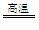 CO+H2 CH4+H2O
CO+H2 CH4+H2O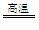 CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?要有计算过程)
(1)CH4(g)+H2O(g)=CO(g)+3H2(g); △H =+206.1 kJ·mol-1(2分)
(2)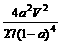 (2分)
(2分)
(3)反应②中 C2H4 ~ CO ~ H2 ~ HOCH2CH2CHO
28 28 2 74
5.(江苏省丹阳高级中学2010届高三上学期期中考试(化学))(9分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:____________________________________________。
Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1
H2O(g)=H2(g)+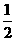 O2(g) △H2=+242kJ·mol-1
O2(g) △H2=+242kJ·mol-1
Mg(s)+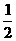 O2(g)=MgO(s) △H3=-602kJ·mol-1
O2(g)=MgO(s) △H3=-602kJ·mol-1
(2)氢氧化镁分解的热化学方程式是_______________________________________。
(3)氢氧化镁可以作为阻燃剂的原因____________________。(写一条即可)
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
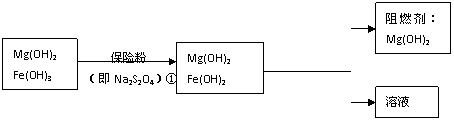

(4)步骤②中分离操作的名称是_____________。
(5)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。
每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是 NA。
(6)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(0H)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。
答:___________________________________________________________________。
(1)Mg(OH)2+2H+=Mg2++2H2O (1分)
(2)Mg(OH)2(s)=MgO(s)+H2O(g) △H=+81kJ·mol-1 (2分)
(3)氢氧化镁分解要吸收大量的热(其他合理答案也参照给分,1分)
(4)过滤 (1分)
(5)0.6 (2分)
(6)Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2  Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使平衡朝右移动而溶解 (2分)
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使平衡朝右移动而溶解 (2分)
4.(江苏金陵中学高三年级期中考试题--化学)“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是 。
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4和作为燃料,其反应的方程式是:
N2O4+N2H4→N2+H2O。请配平该反应方程式:
N2O4+ N2H4→ N2+ H2O
 该反应中被氧化的原子与被还原的原子的物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和铁快速产生大量气体外,还有一个很大的优点是
该反应中被氧化的原子与被还原的原子的物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和铁快速产生大量气体外,还有一个很大的优点是
。
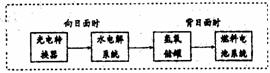
(3)右图是某空间站能量转化系统的局部示
意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:
。如果某段时间
内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为 mol。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH-4e-=O2↑+2H2O
则阴极反应为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0=来消除CO的污染。
请你判断上述反应是否能发生?
理由是: 。
(1)B
(2)1 2 3 4 2:1 产物无污染
(3)H2-2e-+2OH-=2H2O 2
(4)2CO2+4e-+2H2O=2CO+4OH-
不可行 △H>0,吸热 △S<0
3.(江苏金陵中学高三年级期中考试题--化学)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,
能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+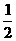 O2(g)=H2O(l)
△H=-285.84kJ·mol-1
O2(g)=H2O(l)
△H=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
(1)BD
(2)Cu(s)+H2O2(l)+2H+(ag)=Cu2+(ag)+2H2O(l) △H=-319.69kJ·mol-1
(3)H2O+2Cu2++SO2-3+Cl=2CuCl↓+SO2-4+2H+
2.(如皋市2010届高三综合测试)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:

(1)写出生成C 的化学方程式并标出电子转移方向和数目: 。
(2)E和N2是等电子体,请写出E的可能电子式: 。
(3)在101kPa和150℃时,可逆反应E(g)+ B(g) F(g)+ D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
F(g)+ D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
A.升高温度 B.增大压强 C.加入催化剂 D.增大一倍原平衡混合气体的量
(4)若G是一种淡黄色固体单质,16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因: 。
(1) (1+1分)
(1+1分)
(2) (1分)
(1分)
(3)B、C (2分) (注:单选给1分,只要选错1个为0分)
(4)S(s) + Fe(s) = FeS(s) △H = -2Q kJ·mol-1 (2分)
C6H5OH
或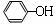 (1分) Fe3++3H2O
(1分) Fe3++3H2O Fe(OH)3+3H+(2分)
Fe(OH)3+3H+(2分)
1. (如皋市2010届高三综合测试)向足量H2SO4溶液中加入100mL 0.4 mol/LBa(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol/LHCl溶液时,放出的热量是2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )
A.Ba2+(aq) + SO42-(aq) = BaSO4(s) △H = -0.72 kJ/ mol
B.Ba2+(aq) + SO42-(aq) = BaSO4(s) △H = -2.92 kJ/ mol
C.Ba2+(aq) + SO42-(aq) = BaSO4(s) △H = -18.0 kJ/ mol
D.Ba2+(aq) + SO42-(aq) = BaSO4(s) △H = -73.0 kJ/ mol
20.
(1)______________________________________。(用离子方程式表示)
(2)
①_______________________________________。
② ______________________________________。
③ _____________________范围内。
(3)
①_________________________。
②
________________________________________________________;
______________________________________________________。



……
19.
(1)____________________。
(2)____________________。
(3) ______________(填“增大”、“不变”或“减小”)。
______________(填“增大”、“不变”或“减小”)。
(4)____________ 。_______________。
。_______________。
(5)___________________。
18.
(1)________________________________。
(2)_________;_____________,_____________。
(3)___________,_____________。
(4)__________________________________;
__________________________________.
(5)
____________________________________。
____________。
(6)_____________。
(7)_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com