
题目列表(包括答案和解析)
4.(江苏省丹阳高级中学2010届高三上学期期中考试(化学))现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中右图所示是已合成的最著名的硫-氮化合物的分子结构。下列说法正确的是 ( )
A.该物质的分子式为SN
 B.该物质的分子中既有极性键,又有非极性键
B.该物质的分子中既有极性键,又有非极性键
C.该物质在固态时形成原子晶体
D.该物质与化合物S2N2互为同素异形体
3.(江苏金陵中学高三年级期中考试题--化学)短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最上层电子数等于A原子次外层电子数。下列叙述中正确的是
A.原子半径:A<B<C
B.C的氢化物稳定性大于A的氢化物的稳定性
C.三种元素的最高价氧化物对应的水化物均可由化合反应得到
D.高温下,A单质能转换出C单质
2.(如皋市2010届高三综合测试)有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的
A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B.若X(OH)n为强碱,则Y(OH)n也一定为强碱
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价也一定为+m
1.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)下列实验能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
浓、稀HNO3分别与Cu反应 |
比较浓、稀HNO3的氧化性强弱 |
|
B |
金属钠投入硫酸铜溶液中 |
置换出铜 |
|
C |
把铜和银用导线连接后插入稀硫酸中 |
组成原电池验证铜比银活泼 |
|
D |
用等浓度的盐酸、碳酸氢钠两溶液混合反应 |
比较盐酸、碳酸的酸性强弱 |
11.(10分)下图是工业生产硝酸铵的流程。
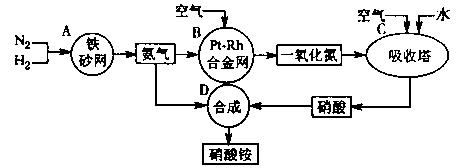
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
(12分,每空2分)
(1)使NO全部转化成HNO3 ABC
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol
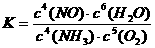
(3)CDE
(4)30%(或29.9%)
10.(江苏省黄桥中学2010届高三期中考试(化学))(8分)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。
己知:C (s) + H2O(g) 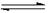 CO (g)
+H2 (g);△H =+131.3kJ•mol-1
CO (g)
+H2 (g);△H =+131.3kJ•mol-1
C (s) + O2(g)=CO (g); △H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l); △H = -285.8kJ·mo1-1
⑴将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中
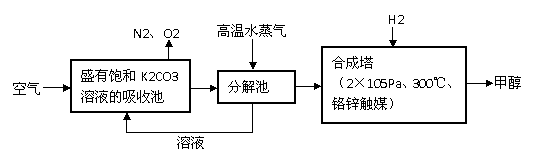 提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小亮应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
⑴ -78.7 (2分)
⑵ CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol(2分)
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol(2分)
⑶ Ba(OH)2(或NaOH溶液和BaCl2溶液) (1分)
实验时的温度、压强,沉淀的质量 (每个各1分,共3分)
9.(江苏省黄桥中学2010届高三期中考试(化学))
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2 O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.上图可表示为CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g ) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
8.(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(2)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式:
②反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
(3).北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g); △H1=156.6
kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1=156.6
kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为_________;放电时,CO32- 移向电池的_______(填“正”或“负”)极。
③常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)_____c(CO32-)
(填“>”、“=”或“<”),原因是_______________________(用文字说明)。
(1)①0.0020 (1分);②1.8 (1分); ③变浅 (1分); ④ D (1分)
(2)①14HNO3+3Cu2O==6Cu(NO3)2+2NO↑+7H2O (1分)
②0.6mol(1分)
③使用了较浓的硝酸,产物中有部分二氧化氮生成(1分)
(3)
.①124.2 (1分)
②C3H8+5O2====3CO2+4H2O;负。(2分)
③ >; HCO3-的水解程度大于电离程度(2分)
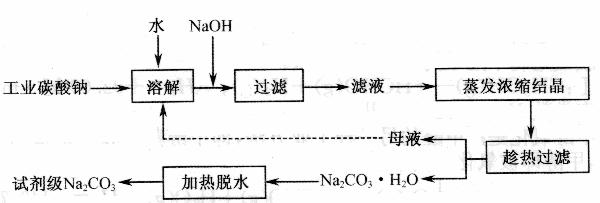
7.( 12分)工业碳酸钠(纯度约为 98 % )中含有 Ca2+、 Mg2+、 Fe3+、 Cl-和 SO42-等杂质,提纯工艺线路如下:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
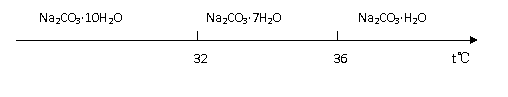

Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1) 加入NaOH溶液时,反应的离子方程式为 。
向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg 2+)∶c(Fe3+)==
( 2 ) “母液”中除了含有 Na+、 CO32-离子外 ,还含有 等离子。
( 3 )有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析实际工业生产中是否可行 (填“可行”或“不可行”)并说明理由 。
( 4 )已知: Na2CO3 ·10H2O ( s ) ==Na2CO3 ( s ) + 10H2O ( g ) △H==+532 .36 kJ·mol-1
Na2CO3 ·10H2O ( s ) ==Na2CO3·H2O ( s ) + 9H2 O( g ) : △H =+473 . 63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
( l ) MgCO3 + 2OH-== Mg(OH )2+ CO32-( 2 分)(说明:书写 Fe3++ 3OH-= Fe ( OH )3↓、 Mg2++ 2OH-== Mg(OH )2↓不扣分,但也不得分) 2 .125×1021 , ( 2 分)
( 2 ) Cl-、 SO42-( 2 分,写出一个得 1 分,只要写错一个不得分)
( 3 )不可行( 2分)
若“母液”循环使用,则溶液: c(Cl-)和c(SO42-)增大,最后所得产物 Na2 CO3 混有杂质(2分)
( 4 ) Na2 CO3·H2O ( s )== Na2 CO3( s ) + H2O ( g ) ; △ H =+58 . 73kJ·mol-1 ( 2 分)
29.6t m(H2)×80%
则m(H2)=1.0 t
反应②、③中共需CO14 t、H22.0 t。
C + H2O CO + H2 CH4
+ H2O
CO + H2 CH4
+ H2O CO +
3H2
CO +
3H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com