
题目列表(包括答案和解析)
23.
 (江苏省江浦高级中学高三化学2010第一轮复习模块检测)右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项
(江苏省江浦高级中学高三化学2010第一轮复习模块检测)右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项
A.硝酸银溶液中加入氨水溶液
B.往澄清石灰水中逐渐通入CO2气体
C.往AlCl3溶液中逐NaOH溶液
D.往NaAlO2溶液中逐滴加入盐酸溶液
22.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)

A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.(2)图显示M中c(NaHCO3)>c(Na2CO3) D.(4)图显示M中c(NaOH)>c(Na2CO3)
21.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
(3)若固体粉末完全溶解无固体存在 , 滴加KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 、 、 。
探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
(1)溶液变为血红色(1分)
(2)不合理 (1分) Cu能将Fe3+还原为Fe2+(1分)
(3)Fe2O3和Cu2O的混合物 Fe2O3+6H+ = 2Fe3++3H2O ; Cu2O+2H+ = Cu + Cu2+ + H2O
2 Fe3+ + Cu = 2 Fe2+ + Cu2+(每个2分,共8分)
(4) (2分)
(2分)
21.(江苏省黄桥中学2010届高三期中考试(化学))由白色和黑色固体组成的混合物A,可以发生如下框所示的一系列变化:


(1)写出反应③的化学方程式: 。
反应④的离子方程式: 。
(2)操作②的名称是 。
(3)下列实验装置中可用于实验室制取气体G的发生装置是 (填序号)。
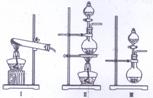
为了得到纯净干燥的气体G,可将气体通入a和b装置,a、b两广口瓶中所装入的溶液依次是a: ,b: 。c、d装置不完整,请在图中补充完整。
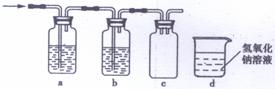
(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出d中发生反应的的离子方程式: ;
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e-i装置中,可用于吸收J的
是 。

(1)MnO2+4HC1(浓) MnC12+C12↑+2H2O(2分)
|
2C1-+2H2O
C12↑+H2↑+2OH-(2分)
(2)溶解、过滤 (2分)
(3)II 饱和食盐水 浓硫酸(2分)
(4)C12+2OH-
C1-+C1O-+H2O(2分)
(5)f h i(2分)
20.(江苏省黄桥中学2010届高三期中考试(化学))下列各组物质中,不能按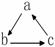 (“→”表示一步完成)关系相互转化的是:
(“→”表示一步完成)关系相互转化的是:
|
选项 |
A |
B |
C |
D |
|
a |
Fe |
SiO2 |
Al(OH)3 |
HNO3 |
|
b |
FeCl3 |
Na2SiO3 |
NaAlO2 |
NO |
|
c |
FeCl2 |
H2SiO3 |
Al2O3 |
NO2 |
19.(江苏省海安高级中学2010届高三10月月考(化学))下图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产
物已略去)。



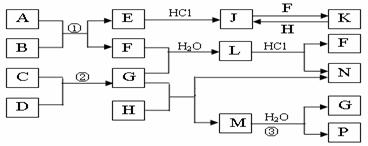
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是 。
(2)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释
。
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O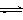 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
18.(江苏省高淳中学2010届高三上学期调研(化学))金属冶炼技术随人类对自然界认识的不断深入而发展。下列金属中,常用作还原剂冶炼其他金属的是
A.Ag B.Cu C.Fe D.Al
17.(江苏省高淳中学2010届高三上学期调研(化学))氨是一种重要的化工原料。下列关于氨气的性质描述不正确的是
A.无色 B.易液化 C.难溶于水 D.有刺激性气味
16.(江苏省高淳中学2010届高三上学期调研(化学))下列关于硅单质及其化合物的说法中,正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①④ B.②③ C.①② D.③④
15.(江苏省高淳中学2010届高三上学期调研(化学))合金具有许多优良的性能。下列物质属于合金的是
A.氧化铜 B.青铜 C.硫 D.钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com