
题目列表(包括答案和解析)
9.(江苏省海安高级中学2010届高三10月月考(化学))某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
⑴已知KBrO3在反应中得到电子,则该反应的还原剂是 。
⑵已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
⑶根据上述反应可推知 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4 > KBrO3
C.还原性:AsH3>X D.还原性:X > AsH3
⑷将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
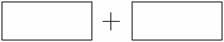
⑴AsH3 ⑵Br2 ⑶AC ⑷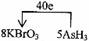
8.(江苏省海安高级中学2010届高三10月月考(化学))物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1:4 B.1:5 C. 2:3 D.2:5
7.(江苏省访仙中学2010届高三上学期期中考试化学)铜的冶炼大致可分为:①富集:将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;
④电解精炼。
下列说法正确的是 ( )
A.上述灼烧过程的尾气均可直接排入空气
B.由6mol CuFeS2生成6mol Cu,反应共消耗15mol O2
C.反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化剂只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
6.(江苏省赣榆一中2010届高三12月阶段考试化学)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式:
②反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
①14HNO3+3Cu2O==6Cu(NO3)2+2NO↑+7H2O (1分)
②0.6mol(1分)
③使用了较浓的硝酸,产物中有部分二氧化氮生成(1分)
5.(江苏省丹阳高级中学2010届高三上学期期中考试(化学))铜的冶炼大致可分为:①富集:将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;
④电解精炼。
下列说法正确的是 ( )
A.上述灼烧过程的尾气均可直接排入空气
B.由6mol CuFeS2生成6mol Cu,反应共消耗15mol O2
C.反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化剂只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
4.(江苏金陵中学高三年级期中考试题--化学)“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是 。
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4和作为燃料,其反应的方程式是:
N2O4+N2H4→N2+H2O。请配平该反应方程式:
N2O4+ N2H4→ N2+ H2O
 该反应中被氧化的原子与被还原的原子的物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和铁快速产生大量气体外,还有一个很大的优点是
该反应中被氧化的原子与被还原的原子的物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和铁快速产生大量气体外,还有一个很大的优点是
。
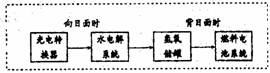
(3)右图是某空间站能量转化系统的局部示
意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:
。如果某段时间
内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为 mol。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH-4e-=O2↑+2H2O
则阴极反应为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0=来消除CO的污染。
请你判断上述反应是否能发生?
理由是: 。
(1)B
(2)1 2 3 4 2:1 产物无污染
(3)H2-2e-+2OH-=2H2O 2
(4)2CO2+4e-+2H2O=2CO+4OH-
不可行 △H>0,吸热 △S<0
3.(如皋市2010届高三综合测试)LiAlH4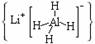 、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法中不正确的是 ( )
、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法中不正确的是 ( )
A.LiH与D2O反应,所得氢气的摩尔质量为4g/mol
B.1 mol LiAlH4在125℃完全分解,转移3 mol电子
C.LiAlH4溶于适量水得无色溶液,则化学方程式可表示为:LiAlH4 + 2H2O = LiAlO2 + 4H2↑
D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
2.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)资料1.据《重庆晚报》2009.8.12报道:在全民补碘政策实施15年之后的今天,来自民间和医学界自主补碘的呼声越来越高。加碘食盐是“防病”还是“致病”?甲状腺疾病频发是否与碘营养过量有关?中国食盐加碘“一刀切”政策或将面临深层次的调整。
资料2.下表是某食用碘盐包装袋上的部分说明:
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
请回答下列问题:
(1)下列说法正确的是 ▲ 。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平)
该化学方程式配平后系数依次为 ▲ 。
w.该反应的还原剂为 ▲ ;1mol KIO3完全反应转移的电子总数为 ▲ 。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) ▲ mg/kg。
(1)B (2分)
(2)1、5、3、3、3、3(2分) KI(2分) 5NA(或3.01×1024) (2分)
(3) 4.2 ×102/w(或1270/3w或423/w)(2分)
1.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
4.(江苏省高淳中学2010届高三上学期调研(化学))乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。
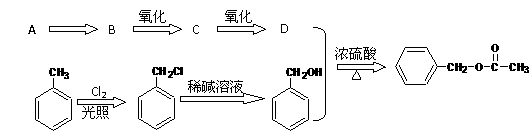
请回答:
(1)运用逆合成分析法推断,C的结构简式为 。
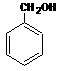
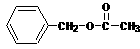
(2)D + → 的化学方程式为

(3)与 互为同分异构体的芳香族化合物有 种,其中一
种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为 。
(1)CH3CHO ……………………………………………………………2分
|
|
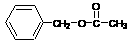
|


|
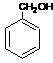
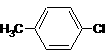 (3)3 ……………………………………………………………………………2分
(3)3 ……………………………………………………………………………2分
…………………………………………………………2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com