
题目列表(包括答案和解析)
5.元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
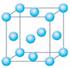 (1)与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有__________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为
。
(1)与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有__________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为
。
(2)MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
4.由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
3.D和E的第一电离能的大小: > (用元素符号表示)
2.D的氢化物的分子构型为 ,该氢化物易溶于水的原因
3.(江苏省赣榆一中2010届高三12月阶段考试化学)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
1请写出元素N的基态原子电子排布式 。
2.(江苏金陵中学高三年级期中考试题--化学)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第上电离能数据(单位:kJ·mol-1),回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”、“p”、“d”、“ds”等)区元素,位于 族。
若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
(1)4Ml3+3F2=NF3+3MH4F
(2)Ml3分子间的形成氢键
(3)[Al]3s54s1
(4)Al3+ 6
(5)①R H
②P 平面三角形 SP2
1.(如皋市2010届高三综合测试)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是
。(填字母)
(2)下列叙述正确的是
。(填字母)
a.M易溶于水,是因为M与水分子间能形成氢键,且M
是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
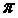
 c.N分子中含有6个 键和1个 键
c.N分子中含有6个 键和1个 键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
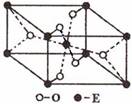
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧原子的配位数为 。
(4)B、C、D三种元素的第一电离能由小到大的顺序为 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为
ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为 。
(1)3d24s2(2分)
(2)ad (2分)
(3)TiO2 3(2+2分)
(4)C<O< N(2分)
(5)[TiCl(H2O)5]2+(2分)
12.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)(8分)2008年5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,当时,全国各地向灾区紧急运送了大量的各种消毒剂、漂白剂等。
(1)84消毒液因其杀菌率高、杀菌种类多、适用范围广,被普遍使用。其主要成分是次氯酸钠,该物质可与硫化钠溶液作用生成硫酸钠,试写出对应的化学反应方程式:
▲ 。
(2)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
▲ 。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2 =4ClO2↑+ H+ +Cl-+2H2O。则该反应中氧化剂与还原剂的质量之比为: ▲ 。
(4)过碳酸钠是一种多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 ▲ 。
A.MnO2 B.稀盐酸 C.KMnO4溶液 D.Na2SO3溶液
(1)4NaClO+Na2S=Na2SO4+4NaCl(2分)
(2)2ClO3-+SO2=2ClO2+SO42- (2分) (3)1:4 (2分) (4)C (2分)
11.(如皋市2010届高三综合测试)已知稀溴水和稀氯化铁溶液都呈黄色,若在足量的稀氯化亚铁溶液中,加入1-2 滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉碘化钾溶液,完成以下实验探究过程:
[提出假设]
假设①:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设②:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
为了验证上述假设①和假设②的推断,请用简要的文字说明你的实验方案:
假设①方案: 。
假设②方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设①”或“假设②”)的推断是正确的;若选用淀粉碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是_______________________________ 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为:
(1)①Br2;②Fe3+ (每空2分,共4分)
假设①方案:向黄色溶液加入CCl4,振荡,静置,下层溶液呈橙红色。(2分)
假设②方案:向黄色溶液滴加KSCN溶液,溶液变为(血)红色 (2分)
(2)假设② (1分);不可行(1分);因为Br2和Fe3+都能把Iˉ氧化成I2使溶液都变蓝,无法得出结论。(2分)
(3)2 Fe2+ + 4 Brˉ + 3Cl2 == 2 Fe3+ +2 Br2 + 6Clˉ (2分)
10.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)已知稀溴水和氯化铁溶液都呈黄色,某化学活动小组进行实验探究。
李强、王刚两同学分别在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液呈黄色。
(1)李强同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是: ▲ (填粒子的化学式);王刚同学则认为这是发生化学反应所致,试写出对应的离子方程式: ▲ 。
(2)如果要验证王刚同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂: A.碘化钾淀粉溶液 B.氢氧化钠溶液 C.硝酸银溶液
D.硫氰化钾溶液 E.四氯化碳 F.酸性高锰酸钾溶液
|
实验方案 |
所选用试剂(填代号) |
实验现象 |
|
方案一 |
▲ |
▲ |
|
方案二 |
▲ |
▲ |
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入少量氯气,则首先被氧化的离子是
▲ (填粒子的化学式);若在稀溴化亚铁溶液中通入过量氯气,则相应的离子方程式为 ▲ 。
①Br2 (1分);2Fe2++Br2=2Fe3++2Br- (2分)
②(每空1分,共4分)
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
D |
溶液变红 |
|
第二种方法 |
E |
有机层无色 |
③Fe2+ (1分);2Fe2++4Br-+3Cl2 2Fe3++2Br2+6Cl- (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com