
题目列表(包括答案和解析)
8.(江苏省黄桥中学2010届高三期中考试(化学))材料(选修三课本第44页实验2-2):向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
 Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与H2O分子互为等电子体的微粒 (填2种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
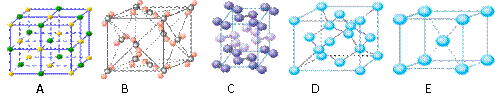
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)。

Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4) 写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。
(5) 实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
(6) 实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
(1) H2S、NH2-
(2)A
(3)BC
(4)3d104s1 Cr
(5)共价键、配位键
(6)降低Cu(NH3)4SO4·H2O的溶解度
7.(江苏省海安高级中学2010届高三10月月考(化学))对Na、Mg、Al的有关性质的叙述不正确的是
A.第一电离能:Na< Mg <Al B.电负性:Na< Mg< Al
C.还原性:Na> Mg >Al D.碱性:NaOH> Mg(OH)2> Al(OH)3
6.(江苏省海安高级中学2010届高三10月月考(化学))下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;⑤N和O元素的第一电离能;⑥H原子和H+离子的半径
A.①④⑤ B.②④⑥ C.④⑤⑥ D.③⑤⑥
5.(江苏省海安高级中学2010届高三10月月考(化学))固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试完成下列问题。
(1)固体A属于________晶体,它的电子式为____________。
(2)A溶于水后,溶液呈___________性(填“酸”“碱”或“中”),其原因是_________________________________(用化学方程式表示)。
(3)A与铜或铜的某些化合物在一定条件下可合成CuH。CuH是一种难溶物,它能与盐酸反应,放出气体,请写出这个反应的化学方程式: _______________________________
(1)离子 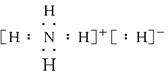
(2)碱 NH4H+H2O====NH3·H2O+H2↑
(3)CuH+HCl====CuCl+H2↑
4.(江苏省海安高级中学2010届高三10月月考(化学))(1)I.图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
 族。
族。
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
 II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、
话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结
构示意图如右图,它的化学式是 ;
晶体内与每个“Ti”紧邻的氧原子数为 个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,
另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这
两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为 。
(1)I.IIIA (1分)
II.IVA (1分);b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水。 (1分)
(2)I.3d24S2 (2分)
II.①BaTiO3 (2分) 6 (2分)
②[TiCl(H2O)5]Cl2 ·H2O(3分)
5.(1) K、Cu 4 (3分)(2)非极性 1分 (3) ①③ 直线形 (2分)
4. 2 2 (各1分,共2分)
3. N O (1分)
2. 三角锥形 与水形成氢键且与水反应 (各1分,共2分)
1. 1s22s22p63s23p63d64s2 (1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com