
题目列表(包括答案和解析)
5、下列各溶液中能大量共存的离子组是 、( )
A.使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、C1-
C.c(H+)=10-14mol/L的溶液中:Na+、A1O2-、S2-、SO32-
D.水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+
4.下列有关物质的结构或性质的叙述错误的是
( )
A.由极性键形成的分子不一定是极性分子
B.水是一种非常稳定的化合物,这是由于氢键所致
C.石英、食盐、金属钠、干冰的熔点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
3.下列实验不能达到预期目的的是
( )
|
序号 |
实验内容 |
实验目的 |
|
A |
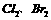 分别与 分别与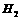 反应 反应 |
比较氯与溴的非金属性强弱 |
|
B |
向饱和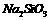 溶液中通入二氧化碳 溶液中通入二氧化碳 |
比较碳与硅的非金属性强弱 |
|
C |
把碳酸钠与亚硫酸钠放置在空气中 |
比较碳与硫的还原性强弱 |
|
D |
向氯化铜溶液中加入铁丝 |
比较铁与铜的还原性强弱 |
2.实验室中,有关试剂的保存方法错误的是 ( )
A.烧碱溶液保存在带玻璃塞的试剂瓶中 B.液溴用水封保存
C.少量金属钠保存在煤油中 D.氯水保存在棕色细口瓶中
1.下列化学用语表示错误的是 ( )
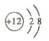 A.镁离子结构示意图
A.镁离子结构示意图
 B.氨分子结构
B.氨分子结构

C.次氯酸电子式
D.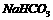 的电离方程式为:
的电离方程式为: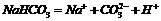
11.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)Na与S反应可以生成多种产物:Na2S,Na2S2……Na2S5。已知Na2S2的电子式为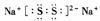 则S32-的电子式为
。已知Na2S3+2HCl
= 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:
。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:
,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为
。
则S32-的电子式为
。已知Na2S3+2HCl
= 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:
。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:
,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为
。
S2-+2CH3COOH==2CH3COO-+H2S+4S
4NaOH==4Na+O2+2H2O
2CO32- -4e-==2CO2+O2
10.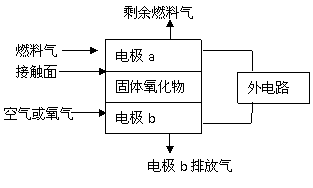 (江苏省黄桥中学2010届高三期中考试(化学))固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
(江苏省黄桥中学2010届高三期中考试(化学))固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=2O2-
B.固体氧化物的作用是让电子在电池内部通过
C.若H2作燃料气,接触面上发生的反应为:H2+2OH--2e-=2H2O
D.若C2H4作燃料气,接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
9.(江苏省海安高级中学2010届高三10月月考(化学))铜的冶炼大致可分为:①富集:将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;
④电解精炼。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排入空气
B.由6mol CuFeS2生成6mol Cu,反应共消耗15mol O2
C.反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化剂只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
8.(江苏省高淳中学2010届高三上学期调研(化学))使用氢氧燃料电池的公共汽车已在北京街头出现。下列有关某种以30%KOH溶液为电解质的氢氧燃料电池的说法中,不正确的是
A.正极反应:O2 + 2H2O + 4e- === 4OH- B.负极反应:H2 - 2e- == 2H+
C.当正极消耗11.2 L O2时,负极消耗22.4 L H2
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
7.(江苏省赣榆一中2010届高三12月阶段考试化学)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(2)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式:
②反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
(3).北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g); △H1=156.6
kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1=156.6
kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为_________;放电时,CO32- 移向电池的_______(填“正”或“负”)极。
③常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)_____c(CO32-)
(填“>”、“=”或“<”),原因是_______________________(用文字说明)。
(1)①0.0020 (1分);②1.8 (1分); ③变浅 (1分); ④ D (1分)
(2)①14HNO3+3Cu2O==6Cu(NO3)2+2NO↑+7H2O (1分)
②0.6mol(1分)
③使用了较浓的硝酸,产物中有部分二氧化氮生成(1分)
(3)
.①124.2 (1分)
②C3H8+5O2====3CO2+4H2O;负。(2分)
③ >; HCO3-的水解程度大于电离程度(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com