
题目列表(包括答案和解析)
20.(12分)为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。
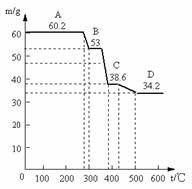 (1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
(1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
当温度在0-280℃质量不变,是什么原因: 。
A→B减少的物质及其物质的量为: ;
C→D减少的物质及其物质的量为: ;
D处化学组成为: 。
(2)乙组取的CA(美国化学文摘)登记号为12304-65-3 的合成水滑石样品,现只知其化学式为:MgaAlb(OH)C(CO3)d, a+b+c+d=25, a、b、c、d为正整数。取该水滑石样品0.1mol,用1mol/L盐酸使其完全溶解。
①消耗盐酸的体积至少为: L(用字母表示);
②若参加反应的盐酸的物质的量与生成CO2的物质的量之比为18∶1,则该水滑石的化学式为: 。
19.(16分)人类利用太阳能已有3000多年的历史,太阳能科技突飞猛进。塑晶学名为新戊二醇(NPG),它和液晶相似,塑晶在恒温44℃时,白天吸收太阳能而贮存热能,晚上则放出白天贮存的热能。NPG是一种白色结晶固体,熔点124-130℃,沸点210℃,主要作为生产聚酯树脂、无油醇酸树脂等。已知:NPG的结构式为:,试回答下列问题:
(1)有关NPG说法正确的是 (填序号)。
A.NPG与乙二醇互为同系物
B.NPG可命名为:2,2-二甲基-1,3-丙二醇
C. NPG一定条件下能发生消去反应
D.研究确定NPG的结构,需经重结晶提纯并干燥、元素定量分析确定分子、相对分子质量测定和波谱分析确定结构
(2)已知同一个碳原子连两个羟基该物质不稳定,与NPG互为同分异构体且属于5碳直链稳定的二元醇有: 种;在其所有异构体中,消去2个水分子得到橡胶单体异戊二烯()的二元醇结构可能有: 种。
(3)NPG可与丙二酸等物质的量缩聚形成一种用途非常广泛的聚酯,该反应的化学方程式为: 。
(4)NPG合成方法之一是利用两种醛加成后再用Cu-ZnO作催化剂加氢得到,已知:
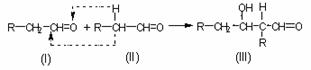
则两种醛的结构简式是: 。
(5)二溴新戊二醇,是一种纤维类织品的阻燃剂,文献记载二溴新戊二醇的合成方法,“季戊四醇先与浓度在98%以上的醋酸进行酯化反应,再通入溴化氢气体进行取代反应,保温后分离出二溴新戊二醇的二酯化物,然后于0.4-0.6Mpa压力下用甲醇和无机酸进行恒压酯分解,该合成方法反应温度低,生成的粗品二溴新戊二醇含量可达88%左右,产品收率高。”
试补充合成路线(只写相关反应物和相关生成物)
→□→□→
18.(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) 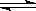 H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 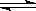 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g)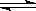 N2 (g)+ 3H2(g)的K=
(填数值)。
N2 (g)+ 3H2(g)的K=
(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
17.(8分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A-F六种元素原子,原子半径最大的是 (填序号)。
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 。
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: 。
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
(三) 试回答下列问题
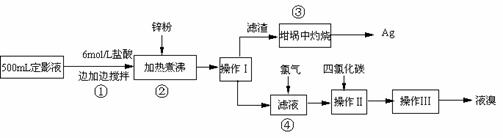
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有: 、 。
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ Ⅱ Ⅲ 。

(3)步骤③是在空气中灼烧的。该反应的化学方程式: 。实验操作时,加入适量的硝酸钾加盖后再灼热,加硝酸钾的目的可能是: 。
(4)加入锌粉发生的离子反应为: 。
16.(8分)铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60-70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
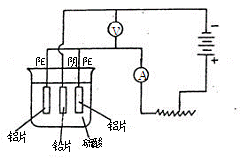 c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20-30min,即可得到更加致密的氧化膜。
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20-30min,即可得到更加致密的氧化膜。
试回答下列问题
(1)用苯和酒精擦拭铝片的目的: ,氢氧化钠溶液处理铝片的目的是: 。
(2)下列有关说法正确的是 (填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+  2Al3+ +3H2↑
2Al3+ +3H2↑
(3)阴极的电极反应式为: 。
(二) 实验程序设计
(一) 资料支撑:
① 定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:AgBr(s)+ 2Na2S2O3(aq) = Na3[Ag(S2O3)2](aq) + NaBr(aq)。
② 在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S。反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O。
③溶液中有少量溴化银,可用锌将其还原出来。
15.(8分)据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的。
某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴。
14.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
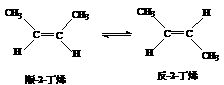 △H= -4.2 kJ/mol
△H= -4.2 kJ/mol
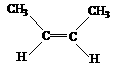 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A.顺-2-丁烯比反-2-丁烯稳定 B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯氢化的热化学方程式为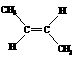 (g)+H2(g)→CH3CH2CH2CH3(g)
(g)+H2(g)→CH3CH2CH2CH3(g)
△H=-114.7kJ/mol
第Ⅱ卷(非选择题 共72分)
13.下列说法不正确的是
A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存
B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连
C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同
D.0.1mol/L 弱酸HA溶液与0.05mol/L NaOH溶液等体积混合后所得溶液微粒浓度间有: 2c(H+)+c(HA) = c(A-)+2 c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com