
题目列表(包括答案和解析)
18.(12分)
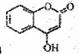 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
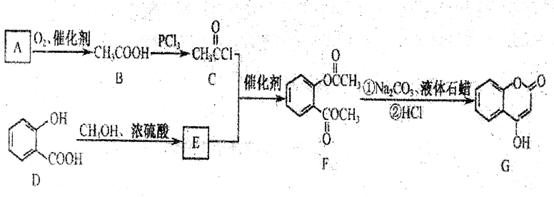
(1)A与银氨溶液反应有银镜生成,则A的结构简式是
(2)B→C的反应类型是 。
(3)写出两种满足下列条件的E的同分异构体的结构简式
①苯环上的一取代产物只有两种:②能发生银镜反应;③能与FeCl3溶液发生显色反应。
(4)写出下和过量NaOH溶液共热时反应的化学方程式:
(5)下列关于G的说法正确的是
a.能与溴的四氯化碳溶液反应 b.能与金属钠反应
c.1 molG最多能和3mol氢气反应 d.分子式是C9H6O3,
(6)请设计合理的方案以苯酚和乙醇为原料合成乙酸苯酯( )用合成路线流程图表示,并注明反应条件)。提示:
)用合成路线流程图表示,并注明反应条件)。提示:
①合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:
17. (10分)
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
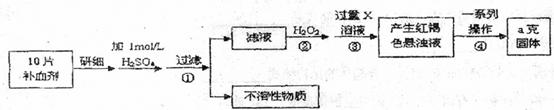
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式
(3)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(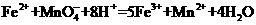 )
)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸他的酸是 。
a. 稀硝酸 b.稀硫酸 c.稀盐酸d.浓硝酸
③某同学设计的下列滴定方式中,最合理的是 (夹持部分略起)(填字母序号)
16.(17分)
(I)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制各二甲醚和甲醇的工业流程如下:

请填空:
(1)在一定条件下,反应室l中发生反应:
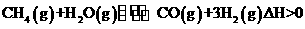 在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0mLCH4和2.0molH2O通入反应室1(假设容积为100L,10min末有0.lmolCO生成,则10min内反应的平均速率
在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0mLCH4和2.0molH2O通入反应室1(假设容积为100L,10min末有0.lmolCO生成,则10min内反应的平均速率
V(H2)= 。
(2)在一定条下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
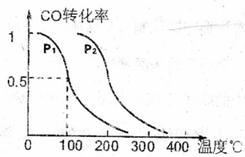 (3)在压强为0.1MPa条件下.反应室3(容积为VL)amolCO与2amolH2在催化剂作用下反应生成甲醇:
(3)在压强为0.1MPa条件下.反应室3(容积为VL)amolCO与2amolH2在催化剂作用下反应生成甲醇: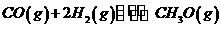 ,CO的平衡转化率与温度、压强的关系如右图所示,则:
,CO的平衡转化率与温度、压强的关系如右图所示,则:
①P1 P2,正反应的 =0,(填“<”
、“>”或“=”).
=0,(填“<”
、“>”或“=”).
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”。下同)。平衡常数 。
③在Pl压强下,100℃时,
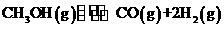 ,反应的平衡常数为
(用含a、V的代数式表示)。
,反应的平衡常数为
(用含a、V的代数式表示)。
(II)(4)在25℃下,向浓度均为0.1 mol ·L-1的mgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11n,Ksp[Cu(OH)2]=2.2×10-20。
(5)在25℃下,将a mol ·L-1的氨水与0.01 mol ·L-1的盐酸等体积混合,反应平衡时溶液中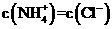 。则溶液显
性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=
。
。则溶液显
性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=
。
15. (10分)
下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图l、图2,回答下列问题:
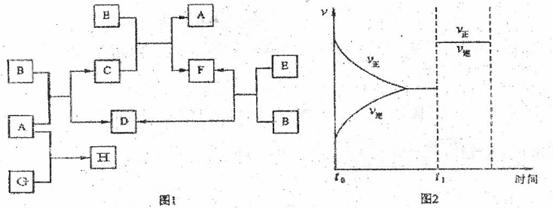
(1)写出生成C的化学方程式并标出电子转移方向和数目: 。
(2)E和N2是等电子体,请写出E的可能电子式: 。
(3)在101kPa和150℃时,可逆反应E(g)+B(g) F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
A.升高温度 B.增大压强
C.加入催化剂 D.增大一倍原平衡混合气体的量
(4)若G是一种淡黄色固体单质,16gG和足量的A反应放出的热量为Q kJ(Q>O),写出这个反应的热化学方程式: 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因:
。
14.(10分)
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定;加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
 (未配平)
(未配平)
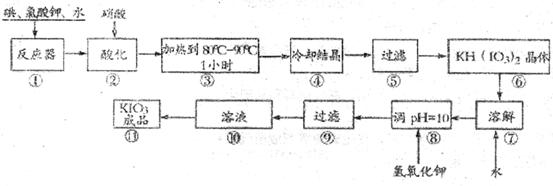
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式: ;
(2)步骤②中.用稀酸酸化的作用是 ;
在稀硝酸和稀盐酸中不能选用的酸是: ,其原因是
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 .
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
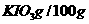 水 水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
13.(10分)
用含少量铁的氧化铜制取氯化铜晶体(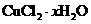 )。有如下操作:
)。有如下操作:

已知:在pH为4-5时,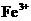 几乎完全水解而沉淀,而此时
几乎完全水解而沉淀,而此时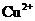 却几乎不水解。
却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)
①C12 ②KMnO4 ③HNO3 ④H2O2
(2)要得到较纯的产品,试剂B可选用
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)试剂B的作用是
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是 (按实验先后顺序选填编号)
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)为了测定制得的氯化铜晶体(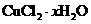 )中x值,某兴趣小组设计了两种实验方案:
)中x值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为mg。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是 ,据此计算得x=
(用含m、n的代数式表示)。
12.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氧化物的水化物一定是强酸
D.X和Z的最高价氧化物对应的水化物都是弱酸
非选择题部分(共78分)
11.已知NO2和N2O4可以相互转化: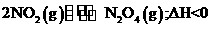 。现将一定量NO2
。现将一定量NO2
和N2O4的混合气体通入容积为1L的恒温密闭容器中,反应物和生成物浓度随时间的变化关系如右图所示。下列有关说法中错误的是
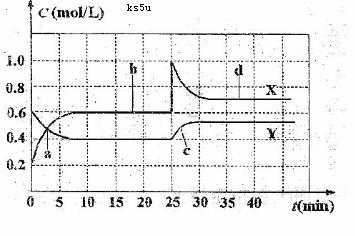
A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积
D.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
10.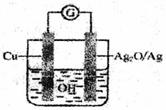 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O十2Ag下列有关说法正确的是
普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O十2Ag下列有关说法正确的是
A.工业上以黏土、石灰石和石英为主要原料来制造普通水
泥
B.负极的电极反应式为: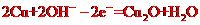
C.测量原理示意图中,电流方向从Cu经过导线流向Ag2O
D.电池工作时,溶液中 向正极移动
向正极移动
9.有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与Na2CO3;②CH3COONa与NaCl;③CH3COONa与NaOH;④CH3COONa与HCl。C(CH3COO一)排序正确的是
A.③>①>②>④ B.③>②>①>④
C.④>②>①>③ D.④>②>③>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com